题目内容
【题目】氟化钡可用于制造电机电刷、光学玻璃、光导纤维、激光发生器。以钡矿粉(主要成分为BaCO3,含有SiO2、Fe2+、Mg2+等杂质)制备氟化钡的流程如下:
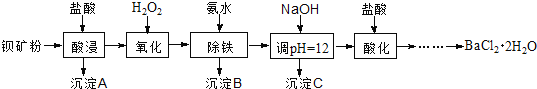
已知:常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4。
(1)滤渣A的名称为___________。
(2)滤液1加H2O2的目的是___________。
(3)加NaOH溶液调节pH=12.5,得到滤渣C的主要成分是___________(写化学式)
(4)滤液3加入盐酸酸化后再经加热浓缩____________洗涤,真空干燥等一系列操作后得到BaCl2·2H2O晶体。
(5)常温下,用BaCl2·2H2O配制成0.2 mol/L水溶液与氟化铵溶液反应,可得到氟化钡沉淀。请写出该反应的离子方程式___________。已知Ksp(BaF2)=1.84×10-7,当钡离子完全沉淀时(即钡离子浓度≤10-5 mol/L),至少需要的氟离子浓度是___________mol/L(已知![]() =1.36,计算结果保留三位有效数字)。
=1.36,计算结果保留三位有效数字)。
(6)5.0 t含80%BaCO3的钡矿粉,理论上最多能生成BaCl2·2H2O晶体___________t 。(保留2位小数)
【答案】 二氧化硅 将Fe2+氧化成Fe3+ Mg(OH)2 冷却结晶、过滤 Ba2++2F-=BaF2↓ 0.136 4.95
【解析】(1)钡矿粉主要成分为BaCO3,含有SiO2、Fe2+、Mg2+等杂质,其中二氧化硅不溶于盐酸,故滤渣A是二氧化硅。(2)滤液1中含有钡离子、亚铁离子、镁离子、氢离子、氯离子,加入H2O2将亚铁离子氧化为三价铁离子,有利于后续与镁离子的分离;(3)铁元素在除铁步骤中已除云,加NaOH溶液调节pH=12.5,是将镁离子转化为Mg(OH)2沉淀而除去;(4)要得到结晶水合物,常用加热浓缩、冷却结晶、过滤洗涤的方法。(5) BaCl2溶液与氟化铵溶液反应生成氟化钡沉淀,离子方程式为:Ba2++2F-=BaF2↓;由Ksp(BaF2)的表达式可知,c(Ba2+)·c2(F-)= Ksp(BaF2),代入数据:10-5 mol/L×c2(F-)= 1.84×10-7,c(F-)=0.136mol/L;
(6)由关系式可知:
BaCO3 ——BaCl2·2H2O
197 244
5.0 t×80% m m =4.95t

【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。

(1)装置A是氯气的发生装置,请写出相应反应的化学方程式:__________。
(2)装置B中饱和食盐水的作用是___________;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:_______________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III处依次放入物质的组合应是_________填字母编号)。
编号 | I | II | III |
a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是__________________________,该现象__________(填“能”或“不能”)说明溴单质的氧化性强于碘,原因是____________。
(5)装置F的作用是__________________,其烧杯中的溶液不能选用下列中的_____(填字母编号)。
a.饱和NaOH溶液 b.饱和Ca(OH)2溶液
c.饱和Na2SO3溶液 d.饱和Na2CO3溶液
【题目】以高氯冶炼烟灰(主要成分为铜锌的氯化物、氧化物、硫酸盐,少量铁元素和砷元素)为原料,可回收制备Cu和ZnSO4H2O,其主要实验流程如下:
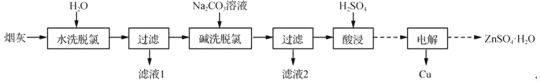
已知:①Fe3+完全沉淀pH为3.2,此时Zn2+、Cu2+未开始沉淀;
②K3[Fe(CN)6]可用于检验Fe2+:3Fe2++2[Fe(CN)6]3﹣═Fe3[Fe(CN)6]2↓(深蓝色);
③砷元素进入水体中对环境污染大,可通过沉淀法除去。
(1)两段脱氯均需在85℃条件下进行,适宜的加热方式为_____。
(2)碱洗脱氯时,溶液中Cu2+主要转化为Cu(OH)2和Cu2(OH)2CO3,也会发生副反应得到Cu2(OH)3Cl沉淀并放出气体,该副反应的离子方程式为_____。若用NaOH溶液进行碱洗操作时,浓度不宜过大,通过下表的数据分析其原因是_____。
NaOH溶液浓度对脱氯率和其他元素浸出率的影响
NaOH浓度/molL﹣1 | 脱氯率/% | 元素浸出率/% | ||
Cl | Zn | Cu | As | |
1.0 | 51.20 | 0.51 | 0.04 | 0.00 |
2.0 | 80.25 | 0.89 | 0.06 | 58.87 |
3.0 | 86.58 | 7.39 | 0.26 | 78.22 |
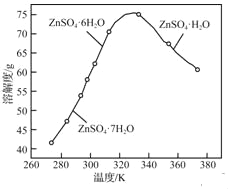
(3)ZnSO4的溶解度曲线如下图所示。“电解”后,从溶液中回收ZnSO4H2O的实验、操作为_____。
(4)滤液1和滤液2中含一定量的Cu2+、Zn2+.为提高原料利用率,可采取的措施有:将滤液1和滤液2混合,回收铜锌沉淀物;循环使用电解过程产生的_____(填化学式)。
(5)已知H3AsO3的还原性强于Fe2+,Ksp(FeAsO3)>Ksp(FeAsO4)=5.7×10﹣21.测得酸浸液中杂质铁元素(以Fe2+存在




