题目内容
【题目】硒及其化合物在工农业生产中有重要用途,硒也是人体必需的微量元素。
(1)硒(34Se)在周期表中位于硫下方,画出其原子结构示意图_____________。
(2)氧族元素单质均能与H2反应生成H2X,用原子结构解释原因_______________。
(3)298K、1.01×l0-5Pa,O2、S、Se、Te分别与H2化合的反应热数据如图所示。写出Se与H2化合的热化学反应方程式__________________。
(4)可以从电解精炼铜的阳极泥中提取硒,通过化学工艺得到亚硒酸钠等含硒物质。常温下,Se(Ⅳ)溶液中各组分的物质的量分数随pH变化曲线如图。
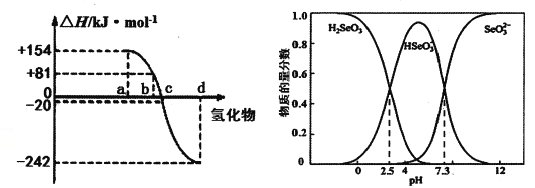
①向亚硒酸溶液滴入NaOH溶液至pH =5,该过程中主要反应的离子方程式________。
②在pH<0的酸性环境下,向Se(Ⅳ)体系中通入SO2制得单质Se的化学方程式是_______。
③下列说法正确的是____(填字母序号)。
a.NaHSeO3溶液显酸性
b.pH=8时,溶液中存在c(HAsO3-)+2c(SeO32-)+c(OH-)=c(H+)
c.在Na2SeO3溶液中,c(SeO32-》c(HSeO3-)> c(H2SeO3)
④常温下,H2SeO3的第二步电离平衡常数为K2,计算K2=________。
【答案】 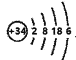 氧族元素原子的最外层电子数均为6 Se(s)+H2(g)=H2Se(g) △H=+81 kJ/mol H2SeO3+OH一=HSeO3一+H2O H2O+ H2SeO3+2SO2=Se+ 2H2SO4 ac 10-7.3
氧族元素原子的最外层电子数均为6 Se(s)+H2(g)=H2Se(g) △H=+81 kJ/mol H2SeO3+OH一=HSeO3一+H2O H2O+ H2SeO3+2SO2=Se+ 2H2SO4 ac 10-7.3
【解析】(1)硫原子核外电子排布为![]() ,硒(34Se)在周期表中位于下方,电子层应该为四层,最外层有6个电子,原子结构示意图
,硒(34Se)在周期表中位于下方,电子层应该为四层,最外层有6个电子,原子结构示意图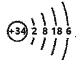 ;正确答案:
;正确答案: 。
。
(2)氧族元素原子的最外层电子数均为6,均能与2个氢原子形成2个共价键,所以氧族元素单质均能与H2反应生成H2X;正确答案:氧族元素原子的最外层电子数均为6 。
(3)O2、S分别与H2化合,均为放热反应,Se、Te分别与H2化合均为吸热反应,且Se的非金属性强于Te,所以吸收的热量要小一些,依据图形可以看出+81 kJ/mol为Se(s)与H2(g)化合的热效应;方程式为Se(s)+H2(g)=H2Se(g) △H=+81 kJ/mol;正确答案: Se(s)+H2(g)=H2Se(g) △H=+81 kJ/mol。
(4)①从图像可出,向亚硒酸溶液滴入NaOH溶液至pH =5时,溶液中HSeO3一离子浓度最大,所以过程中主要反应的离子方程式H2SeO3+OH一=HSeO3一+H2O;正确答案:H2SeO3+OH一=HSeO3一+H2O。
②在pH<0的酸性环境下,向H2SeO3溶液中通入还原性气体SO2,就能够把+4价的Se还原到0价,+4价的硫氧化到+6价,反应的化学方程式是H2O+ H2SeO3+2SO2=Se+ 2H2SO4;正确答案:H2O+ H2SeO3+2SO2=Se+ 2H2SO4。
③从图像看出,H2SeO3第一步电离平衡常数为 c(HSeO3一)×c(H+)/c(H2SeO3),当c(H+)=10-2.5mol/L,c(HSeO3一)= c(H2SeO3),K1=10-2.5; NaHSeO3溶液水解平衡常数为Kh=Kw/ K1=10-14/10-2.5=10-11.5,水解能力小于电离能力,该溶液显酸性,a正确;溶液遵循电荷守恒规律:c(HAsO3-)+2c(SeO32-)+c(OH-)=c(H+)+c(Na+),b错误;在Na2SeO3溶液中,水解显碱性,所以c(SeO32-》c(HSeO3-)> c(H2SeO3)顺序正确;c正确;正确选项ac。
④根据图像可知,常温下,H2SeO3第二步电离平衡常数为c(SeO32-) ×c(H+)/ c(HSeO3一);当c(H+)=10-7.3mol/L,c(HSeO3一)= c(SeO32-),K2=10-7.3;正确答案:10-7.3。

 阅读快车系列答案
阅读快车系列答案【题目】研究+6价铬盐不同条件下微粒存在形式及氧化性,某小组同学进行如下实验:
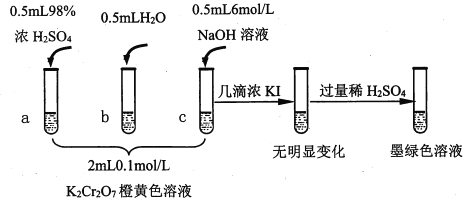
已知:Cr2O72- (橙色)+H2O![]() 2CrO42-(黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
2CrO42-(黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(1)试管c和b对比,推测试管c的现象是________。
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?____(“是”或“否”),理由是_________________________________。
(3)对比试管a、b、c的实验现象,得到的结论是________________。
(4)试管c继续滴加KI溶液、过量稀H2SO4,分析上图的实验现象,得出的结论是_______;写出此过程中氧化还原反应的离子方程式________________。
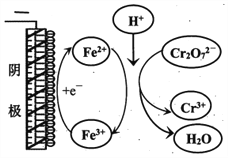
(5)小组同学用电解法处理含Cr2O72-废水,探究不同因素对含Cr2O72-废水处理的影响,结果如下表所示(Cr2O72-的起始浓度,体积、电压、电解时间均相同)。
实验 | ⅰ | ⅱ | ⅲ | ⅳ |
是否加入Fe2(SO4)3 | 否 | 否 | 加入5g | 否 |
是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL |
电极材料 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴极为石墨,阳极为铁 |
Cr2O72-的去除率/% | 0.922 | 12.7 | 20.8 | 57.3 |
①实验ⅱ中Cr2O72-放电的电极反应式是________________。
②实验ⅲ