题目内容
【题目】某同学设计实验探究工业制乙烯原理和乙烯的主要化学性质,实验装置如下页图所示: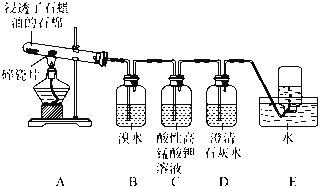
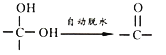
(1)工业制乙烯的实验原理是,烷烃(液态)在催化剂和加热条件下发生反应生成不饱和烃。已知烃类都不与碱反应。例如,石油分馏产物之一十六烷烃发生如下反应,反应式已配平:C16H34![]() C8H18+甲 甲
C8H18+甲 甲![]() 4乙
4乙
甲的分子式为________;乙的结构简式为________。
(2)B装置中实验现象可能是________,写出化学方程式:________________________;反应类型是________。
(3)C装置的现象是____________,反应类型是____________。
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应生成二氧化碳。根据本实验中装置________(填序号)实验现象判断该资料是否真实。为了探究溴与乙烯反应是加成反应而不是取代反应,可以测定B装置里溶液反应前后的pH,简述理由:__________________________。
(5)通过上述实验探究,检验甲烷和乙烯的方法是__________________(填序号,下同);除去甲烷中乙烯的方法是_______。
A.气体通入水中
B.气体通过装溴水的洗气瓶
C.气体通过装酸性高锰酸钾溶液的洗气瓶
D.气体通过氢氧化钠溶液
【答案】 C8H16 CH2===CH2 橙色(或橙黄色) 褪去 CH2===CH2+Br2―→CH2Br—CH2Br 加成反应 紫色(或紫红色)褪去 氧化反应 D 若乙烯与溴发生取代反应则生成溴化氢,使溶液的酸性增强,pH变小;若乙烯与溴发生加成反应,则溴被消耗,溶液的酸性减弱,pH增大 BC B
【解析】(1)石油裂化属于化学反应,遵循原子个数守恒,![]() 甲,所以甲分子式为:
甲,所以甲分子式为:![]() ;根据方程式:
;根据方程式:![]() 乙,结合原子个数守恒可以知道,乙为:
乙,结合原子个数守恒可以知道,乙为:![]() ,结构简式为:
,结构简式为:![]() ;正确答案: C8H16; CH2=CH2 。
;正确答案: C8H16; CH2=CH2 。
(2) 乙烯含有碳碳双键,能够与溴发生加成反应而使溴水褪色,方程式为: CH2===CH2+Br2―→CH2Br—CH2Br;正确答案:橙色(或橙黄色) 褪去; CH2===CH2+Br2―→CH2Br—CH2Br ; 加成反应。
(3) 乙烯具有还原性,能够被酸性高锰酸钾溶液氧化,导致高锰酸钾溶液褪色;反应:![]() →
→![]() ;正确答案:紫色褪色(或变浅);氧化反应。
;正确答案:紫色褪色(或变浅);氧化反应。
(4) 乙烯与酸性高锰酸钾溶液反应生成二氧化碳,进入到澄清的石灰水中,石灰水变浑浊,因此可以根据此现象判定结论的真实性;为了探究溴与乙烯反应是加成反应而不是取代反应,可以测定B装置里溶液反应前后的pH,具体操作为乙烯与溴发生取代反应则生成溴化氢,使溶液的酸性增强,pH变小;若乙烯与溴发生加成反应,则溴被消耗,溶液的酸性减弱,pH增大;正确答案:D;若乙烯与溴发生取代反应则生成溴化氢,使溶液的酸性增强,pH变小;若乙烯与溴发生加成反应,则溴被消耗,溶液的酸性减弱,pH增大。
(5)烃都不溶于水,烷烃与溴水、酸性高锰酸钾溶液、氢氧化钠溶液等不发生反应,而乙烯与溴水、酸性高锰酸钾溶液等发生反应;因此检验甲烷和乙烯的方法可以用溴水或酸性高锰酸钾溶液,乙烯均能使上述溶液褪色,而甲烷不能;BC正确;酸性高锰酸钾溶液能够把乙烯氧化为二氧化碳,溴水与乙烯发生加成生成液态油状物,因此除去甲烷中乙烯的方法是气体通过装溴水的洗气瓶,可以达到目的,B正确;正确选项:BC ;B。