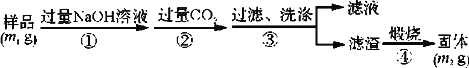��Ŀ����
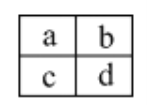
����Ŀ��A��B��C��D���Ƕ�����Ԫ�أ�ԭ�Ӱ뾶D>C>A>B������A��B����ͬһ���ڣ�A��C����ͬһ���塣Cԭ�Ӻ�������������A��Bԭ�Ӻ���������֮�ͣ�Cԭ��������ϵĵ�������Dԭ��������������4�����Իش�
(1)������Ԫ�طֱ��ǣ�A________��B________��C________��D________��(������)
(2)������Ԫ�����ڳ��³�ѹ�µ�Һ̬����̬�⻯����ȶ����ɴ��С��˳����____________��
(3)A��B�γɵ���ԭ�ӷ��ӵĵ���ʽ��________�� B��D�γ�ԭ�Ӹ�����Ϊ1��1�Ļ�����ĵ���ʽ��__________��
���𰸡�̼ �� �� �� H2O>CH4>SiH4 ![]()
![]()
��������
A��B��C��D���Ƕ�����Ԫ�أ�ԭ�Ӱ뾶D>C>A>B������A��B����ͬһ���ڣ�A��C����ͬһ���壬����Ԫ�������ڱ��еĴ������λ��Ϊ��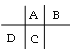 ��A��C����ͬһ���壬�������������8��Cԭ�Ӻ�������������A��Bԭ�Ӻ���������֮�ͣ���B��������Ϊ8��BΪOԪ�أ�Cԭ��������ϵĵ�������Dԭ��������������4������C����������Ϊ4��D������������Ϊ1�����AΪCԪ�أ�CΪSiԪ�أ�DΪNaԪ�أ��ݴ˽����⡣
��A��C����ͬһ���壬�������������8��Cԭ�Ӻ�������������A��Bԭ�Ӻ���������֮�ͣ���B��������Ϊ8��BΪOԪ�أ�Cԭ��������ϵĵ�������Dԭ��������������4������C����������Ϊ4��D������������Ϊ1�����AΪCԪ�أ�CΪSiԪ�أ�DΪNaԪ�أ��ݴ˽����⡣
(1)������ķ�����֪��AΪCԪ�أ�BΪOԪ�أ�CΪSiԪ�أ�DΪNaԪ�أ�������Ԫ�ص�Ԫ�����Ʒֱ���̼�������衢�ƣ�
(2)����Ԫ�����ڳ��³�ѹ����Һ̬����̬�⻯�����C��O��Si����Ӧ���⻯��Ļ�ѧʽΪCH4��H2O��SiH4������Ԫ�صķǽ�������ǿ������˳��Ϊ��O>C>Si��Ԫ�صķǽ�����Խǿ������Ӧ���⻯����ȶ��Ծ�Խǿ������⻯����ȶ���ΪH2O>CH4>SiH4��
(3)A��B�γɵ���ԭ�ӷ���ΪCO2��Cԭ���������4�����ӣ���2��Oԭ�ӵ�2���ɵ������γ�2�Թ��õ��Ӷԣ��Ӷ�ʹ������ÿ��ԭ�Ӷ��ﵽ8�����ӵ��ȶ��ṹ�������ʽ��![]() ��B��D�γɵ�ԭ�Ӹ�����Ϊ1��1�Ļ�����ΪNa2O2������ԭ���������6�����ӣ�2��Oԭ���γ�1�Թ��õ��Ӷԣ�ÿ��Oԭ���ٻ��1�����ӣ��Ӷ��γ�O22-��ÿ��ԭ�������8�����ӵ��ȶ��ṹ��Naԭ��ʧȥ������1�����ӣ�������Ϊ����㣬�γ�Na+���ﵽ8�����ӵ��ȶ��ṹ��Na+��O22-�γ����Ӽ������ĵ���ʽ��
��B��D�γɵ�ԭ�Ӹ�����Ϊ1��1�Ļ�����ΪNa2O2������ԭ���������6�����ӣ�2��Oԭ���γ�1�Թ��õ��Ӷԣ�ÿ��Oԭ���ٻ��1�����ӣ��Ӷ��γ�O22-��ÿ��ԭ�������8�����ӵ��ȶ��ṹ��Naԭ��ʧȥ������1�����ӣ�������Ϊ����㣬�γ�Na+���ﵽ8�����ӵ��ȶ��ṹ��Na+��O22-�γ����Ӽ������ĵ���ʽ��![]() ��
��

 ����С״Ԫ��������������ϵ�д�
����С״Ԫ��������������ϵ�д�