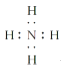题目内容
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
① CO(g)+2H2(g)![]() CH3OH(g) ΔH1 =-99kJ·mol-1
CH3OH(g) ΔH1 =-99kJ·mol-1
② CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
③ CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
(1)CO2的电子式是________________。
(2)ΔH3=______kJ·mol-1,②反应正向的熵变ΔS______0(填“>”“<”或“=”)。
(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(上述②反应),在其他条件不变时,温度T1、T2对反应的影响图像如图。
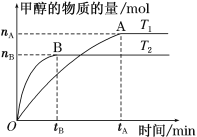
①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=_____ mol·L-1·min-1。
②图示的温度T1______T2(填写“>”、“<”或“=”)
(4)T1温度时,将2 mol CO2和6 mol H2充入2 L密闭容器中,充分反应(上述②反应)达到平衡后,若CO2转化率为50%,此时容器内的压强与起始压强之比为________;反应②在该温度达到平衡时,其平衡常数的数值为_______。
(5)若反应②在原电池条件下实现,请写出酸性条件下惰性电极上由CO2生成CH3OH的电极反应式:____________________,该电极为原电池的_______极。
【答案】![]() +41 <
+41 < ![]() < 3∶4 0.148~0.15(或1/6.75以及4/27 ) CO2 + 6e- + 6H+ = CH3OH + H2O 正
< 3∶4 0.148~0.15(或1/6.75以及4/27 ) CO2 + 6e- + 6H+ = CH3OH + H2O 正
【解析】
(1)CO2的电子式为![]() 。
。
(2)应用盖斯定律计算ΔH3。反应②正向的ΔS<0。
(3)①根据图像中数值用公式υ=![]() 计算υ(CH3OH)。
计算υ(CH3OH)。
②用“先拐先平”法分析,图像中T2先出现拐点,T2反应速率快,则T1<T2。
(4)用三段式和化学平衡常数的表达式计算。
(5)1molCO2得到6mol电子生成1molCH3OH,结合原子守恒、电荷守恒写电极反应式;该反应为还原反应,在原电池的正极上发生。
(1)CO2的电子式为![]() 。
。
(2)分析各热化学方程式,应用盖斯定律,将②-①得,CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH3=ΔH2-ΔH1=(-58kJ/mol)-(-99kJ/mol)=+41kJ/mol。反应②中气体反应物的化学计量数之和为4,气体生成物的化学计量数之和为2<4,反应②正向的ΔS<0。
CO(g)+H2O(g)ΔH3=ΔH2-ΔH1=(-58kJ/mol)-(-99kJ/mol)=+41kJ/mol。反应②中气体反应物的化学计量数之和为4,气体生成物的化学计量数之和为2<4,反应②正向的ΔS<0。
(3)①根据图像,温度为T1时,从反应到平衡反应生成CH3OH物质的量为nAmol,生成甲醇的平均速率为υ(CH3OH)=![]() mol/(L·min)=
mol/(L·min)=![]() mol/(L·min)。
mol/(L·min)。
②用“先拐先平”法分析,图像中T2先出现拐点,T2反应速率快,根据温度对化学反应速率的影响知:T1<T2。
(4)用三段式, CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
c(起始)(mol/L)1 3 0 0
c(转化)(mol/L)1×50%=0.5 1.5 0.5 0.5
c(平衡)(mol/L)0.5 1.5 0.5 0.5
在恒温恒容时气体压强之比等于气体物质的量之比,此时容器内的压强与起始压强之比为(0.5+1.5+0.5+0.5):(1+3)=3:4。该反应的平衡常数K=![]() =
=![]() =0.15。
=0.15。
(5)CO2中C元素的化合价为+4价,CH3OH中C元素的化合价为-2价,1molCO2得到6mol电子生成1molCH3OH,结合原子守恒、电荷守恒和酸性条件,CO2生成CH3OH的电极反应式为CO2+6e-+6H+=CH3OH+H2O,该反应为还原反应,该电极为原电池的正极。