题目内容
【题目】草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下
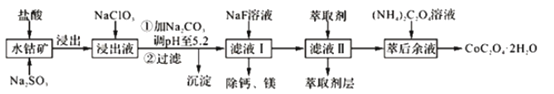
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)CoC2O4·2H2O中C的化合价是____________________________。
(2)写出浸出过程中Na2SO3与Co2O3发生反应的离子方程式:______________。
(3)浸出液中加入NaClO3的目的是____________________________。
(4)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀,沉淀除Al(OH)3外,还有的成分是______________(填化学式),试用离子方程式和必要的文字简述其原理:____________________________。
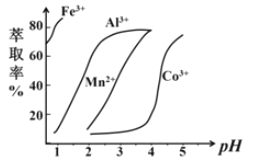
(5)萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是______________;其使用的适宜pH范围是______________。
A. 2.02.5
B. 3.03.5
C. 4.04.5
(6)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀。己知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量 NaF后,所得滤液 c(Mg2+)/c(Ca2+) =______________。
(7)用m1kg水钴矿(含Co2O360%)制备CoC2O4·2H2O,最终得到产品m2kg,产率(实际产量/理论产量×100%)为____________________________。(已知:M(Co2O3)=166, M(CoC2O4·2H2O)=183,仅需列出数字计算式)。
【答案】+3 SO32-+ Co2O3+4H+=2Co2++SO42-+2H2O 将浸出液中的Fe2+氧化成Fe3+ Fe(OH)3 Fe3++3H2O![]() Fe(OH)3+3H+,加入的碳酸钠(或CO32-)与H+反应,c(H+)降低,从而促进水解平衡向右移动 除去溶液中的Mn2+ B 0.7
Fe(OH)3+3H+,加入的碳酸钠(或CO32-)与H+反应,c(H+)降低,从而促进水解平衡向右移动 除去溶液中的Mn2+ B 0.7 ![]() ×100%
×100%
【解析】
用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)制取CoC2O42H2O,水钴矿中加入盐酸,可得CoCl3、FeCl3、AlCl3、MnCl2、MgCl2、CaCl2,信息①中浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等,则加入的Na2SO3将Co3+、Fe3+还原为Co2+、Fe2+;工艺流程最终得到草酸钴,加入NaClO3将Fe2+氧化为Fe3+,加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MnCl2、MgCl2、CaCl2,用NaF溶液除去钙、镁,过滤后,向滤液中加入萃取剂,将锰离子萃取,萃取后的余液中主要含有CoCl2,加入草酸铵溶液得到草酸钴,最后再经蒸发浓缩、冷却结晶、过滤并洗涤得到CoC2O4·2H2O,据此解答。
(1)CoC2O4·2H2O中Co为+2价,O为-2价,根据各元素正、负化合价代数和为0,计算得元素C的化合价是+3价;
(2) 加入的Na2SO3主要Co3+还原为Co2+,发生反应的离子方程式为:Co2O3+4H++SO32-═2Co2++SO42-+2H2O;
(3)浸出液中加入NaClO3的目的是加入 NaClO3发生可以将溶液中Fe2+氧化,进而调节pH除去Fe3+;
(4) 加Na2CO3调节溶液pH=5.2,能使Fe3+、Al3+ 离子转化成Al(OH)3和Fe(OH)3沉淀,原因是:因Fe3+和Al3+水溶液中存在水解平衡Fe3++3H2OFe(OH)3+3H+、Al3++3H2OAl(OH)3+3H+,加入碳酸钠后CO32-与H+结合生成难电离的HCO3-,使水解平衡右移而产生沉淀;
(5) 根据流程图可知,过滤后所得滤液主要含有CoCl2、MnCl2,此时溶液中存在Mn2+、Co2+金属离子,加入萃取剂目的是除去Mn2+,则选取的萃取剂不与水互溶,不与水、Co2+反应,相同条件下杂质离子在萃取剂中溶解度大而Co2+在萃取剂中溶解度小;由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液pH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,故B正确,故答案为B。
(6) 当加入过量NaF后,所得滤液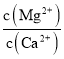 =
=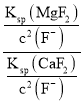 =
=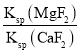 =
=![]() =0.7;
=0.7;
(7) m1kg水钴矿中含Co23的物质的量为![]() ,则CoC2O4·2H2O的理论产量为
,则CoC2O4·2H2O的理论产量为![]() ×2×183g/mol,则产率为
×2×183g/mol,则产率为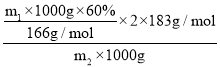 ×100%=
×100%=![]() ×100%。
×100%。

【题目】用活性炭还原法可以处理氮氧化物。某研究小组向2L密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) ![]() N2(g)+CO2(g) △H<0。在T1℃时,反应进行到不同时间测得各物质的浓度(mol/L)如表所示,则下列说法不正确的是
N2(g)+CO2(g) △H<0。在T1℃时,反应进行到不同时间测得各物质的浓度(mol/L)如表所示,则下列说法不正确的是
时间/t(min) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
A. 10~20 min内,NO的平均反应速率为0.018mol/(Lmin)
B. T1℃时,该反应的平衡常数K=0.25
C. 保持与前30min的反应条件相同,再向容器中加入2molN2和2molNO,则平衡向左移动
D. 30min后,只改变了一个条件,根据上述表格判断,该条件可能为缩小容器体积