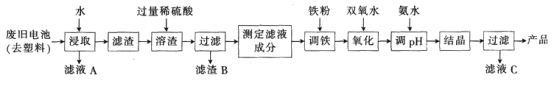
题目内容
【题目】将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol, 这些气体恰好能被 600mL 2molL-1 NaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO2的物质的量为![]()
![]()
A.0.2molB.0.4molC.0.6molD.0.8mol
【答案】D
【解析】
51.2gCu的物质的量为0.8mol,整个反应过程较为复杂,但从氧化还原反应得失电子的角度分析可以简化为铜和氮之间电子的转移,铜和硝酸反应,铜还原硝酸生成氮的氧化物,在NaOH溶液中氮的氧化物又转化为NaNO3和NaNO2,根据得失电子守恒可知铜失去的电子的物质的量等于2倍的NaNO2的物质的量,据此进一步进行计算。
![]() =0.8mol,n(NaOH)=2mol/L×0.6L=1.2mol,整个反应过程中,Cu失去电子数等于NO3-生成NO2-得到的电子数,根据转移电子守恒得n(NaNO2)=
=0.8mol,n(NaOH)=2mol/L×0.6L=1.2mol,整个反应过程中,Cu失去电子数等于NO3-生成NO2-得到的电子数,根据转移电子守恒得n(NaNO2)=![]() =0.8mol;
=0.8mol;
答案选D。

【题目】高铁酸盐在能源、环保等方面有着广泛的用途。利用湿法、干法制备高铁酸盐的原理如表所示。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上利用湿法制备高铁酸钾(K2FeO4)的流程如图所示:

①反应Ⅰ的化学方程式为_____________。
②反应Ⅱ的离子方程式为_______________。
③加入饱和KOH溶液的目的_____________。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为___________。
(3)干法制备K2FeO4的反应中,氧化剂是________。
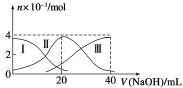
(4)高铁电池是正在研制中的可充电干电池,如图为该电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有________、________。