题目内容
11.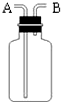 如图是化学中“有名”的装置(万能瓶),有如下用途:
如图是化学中“有名”的装置(万能瓶),有如下用途:(1)可以用做向上排空气法收集氧气,从A端进氧气.
(2)可以用做排水法收集氧气,在集气瓶中装满水,从B端进氧气.
(3)医院里给病人输氧为了给氧气加湿和观察氧气的输出速度也可以在氧气瓶和病人之间连接该装置,在集气瓶装半瓶水,将A端接氧气钢瓶,通过观察气泡产生的快慢就知道氧气的输出速度.
分析 (1)氧气密度大于空气,应该采用向上排空气法收集氧气,导气管遵循“长进短出”原则;
(2)氧气不易溶于水,所以可以采用排水法收集氧气,导气管遵循“短进长出”原则;
(3)导气管应该遵循“长进短出”原则,氧气不易溶于水,所以进入水时会产生气泡.
解答 解:(1)氧气密度大于空气,应该采用向上排空气法收集氧气,导气管遵循“长进短出”原则,则A为进气口,故答案为:A;
(2)氧气不易溶于水,所以可以采用排水法收集氧气,导气管遵循“短进长出”原则,所以B为进气口,故答案为:B;
(3)导气管应该遵循“长进短出”原则,所以A为进气口;氧气不易溶于水,所以进入水时会产生气泡,根据气泡产生快慢确定氧气的输出速度,故答案为:A;气泡产生的快慢.
点评 本题以氧气为载体考查气体的收集,根据气体溶解性、密度确定收集方法,注意(1)(2)中进气口区别及原因,题目难度不大.

练习册系列答案
相关题目
1.将锌片和铜片用导线连接置于稀硫酸溶液中,下列叙述错误的是( )
| A. | 锌片做负极,锌发生氧化反应 | B. | 铜片做正极 | ||
| C. | 溶液中的pH值增大 | D. | 溶液中的H+向负极移动 |
19.某纯净物X在密闭容器中稍加热就分解为NH3、H2O和CO2,根据这一实验事实能得出的结论是( )
| A. | X由四种元素组成 | B. | X是化合物 | C. | X中有水 | D. | X 很稳定 |
20.用试纸检验气体性质是一种重要的实验方法.如下表所示的实验中(可加热),下列试纸的选用、现象、对应结论不正确的一项是( )
| 选项 | 试剂B | 湿润的试纸A | 现象 | 结论 |
| A | 氯水 | pH试纸 | 先变红后褪色 | 氯水具有酸性和漂白性 |
| B | 浓氨水、生石灰 | 蓝色石蕊试纸 | 变红 | 氨气为碱性气体 |
| C | Na2SO3、硫酸 | 品红试纸 | 褪色 | SO2具有漂白性 |
| D | MnO2、浓盐酸 | 淀粉KI试纸 | 变蓝 | 氧化性:Cl2>I2 |
| A. | A | B. | B | C. | C | D. | D |
 CS2熔点高于CO2,其原因是者都为分子晶体,相对分子质量越大,分子间作用力越大
CS2熔点高于CO2,其原因是者都为分子晶体,相对分子质量越大,分子间作用力越大