题目内容
19.某纯净物X在密闭容器中稍加热就分解为NH3、H2O和CO2,根据这一实验事实能得出的结论是( )| A. | X由四种元素组成 | B. | X是化合物 | C. | X中有水 | D. | X 很稳定 |
分析 A、根据质量守恒定律,由生成物可以推测反应物中的元素组成;
B、纯净物X微热就能分解生成NH3、H2O和CO2”说明X是化合物;
C、纯净物X是不可能含有水的;
D、根据题意“微热就能分解”,说明X不稳定.
解答 解:A、根据质量守恒定律,在化学反应中,反应前后原子的个数和种类不变,物质X在隔绝空气的条件下稍加热就分解为NH3,H2O,CO2,说明X是由C、N、H、O四种元素组成的,故A正确;
B、物质X是由C、N、H、O四种元素组成的纯净物,故X是化合物,故B正确;
C、根据质量守恒定律,化学反应的过程,就是参加反应的各物质(反应物)的原子,重新组合而生成其他物质的过程,生成物中有水,不能证明原物质中就有水,且原物质是纯净物,故一定不能含有水,故C错误;
D、根据题意“微热就能分解”,说明X不稳定,故D错误.
故选AB.
点评 根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和;掌握物质的元素组成;掌握单质和化合物的判别.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.干燥剂的干燥性能可用干燥干燥效率(1m立方空气中实际余留水蒸气的质量)来衡量.某些干燥剂的干燥效率如下:
根据以上数据,有关叙述错误的是( )
| 物质 | MgO | CaO | ZnCl2 | ZnBr2 |
| 干燥效率 | 0.008 | 0.2 | 0.8 | 1.1 |
| A. | MgO 的干燥性能比CaO差 | |
| B. | 干燥效率可能与干燥剂的阴阳离子半径大小有关 | |
| C. | MgCl2可能是比CaCl2更好的干燥剂 | |
| D. | 上述干燥剂中阳离子对干燥性能的影响比阴离子大 |
7.电解水这一变化中,没有变化的粒子是( )
| A. | 水分子 | B. | 水原子 | C. | 氢、氧两种原子 | D. | 以上都不是 |
8.原子结构示意图为的 元素是( )
元素是( )
 元素是( )
元素是( )| A. | Li | B. | Na | C. | Al | D. | K |
9.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列各项的事实不能说明上述观点的是( )
| A. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色,而甲烷不能使酸性高锰酸钾溶液褪色 | |
| C. | 乙醇中的乙基对羟基的影响,使羟基的活性变弱,电离H+的能力不及H2O | |
| D. | 苯酚中的羟基氢能与NaOH溶液反应,而醇羟基氢不能与NaOH溶液反应 |
 (填字母符号)
(填字母符号)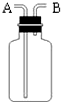 如图是化学中“有名”的装置(万能瓶),有如下用途:
如图是化学中“有名”的装置(万能瓶),有如下用途: