题目内容
【题目】甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。

(1)常温下,FeCl3溶液的pH____7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
①甲同学认为步骤Ⅰ中溶液呈红褐色是因为生成了Fe(OH)3,用化学平衡移动原理解释溶液呈红褐色的原因______________
②乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:__________
![]() Fe3++
Fe3++![]() SO
SO![]() +
+![]() ________——
________——![]() Fe2++
Fe2++![]() ________+
________+![]() ________
________
乙同学查阅资料得知:
ⅰ.Fe2+与![]() 反应生成墨绿色的絮状沉淀FeSO3
反应生成墨绿色的絮状沉淀FeSO3
ⅱ.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成了如下实验:

甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3。而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是____。
(4)为进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成了如下实验:

①经检验步骤Ⅲ中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是________(填字母)。
a.K3[Fe(CN)6]溶液 b.KSCN溶液 c.KMnO4溶液
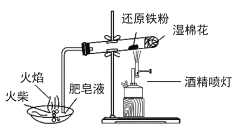
②已知H2SO3是弱酸,请结合电离方程式说明步骤Ⅲ中出现红褐色的原因:_____________
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
【答案】< Fe3+ + 3H2O![]() Fe(OH)3 + 3H+,加入Na2SO3后,c(H+)减小,平衡正向移动,生成的Fe(OH)3增多 2Fe3+ +SO
Fe(OH)3 + 3H+,加入Na2SO3后,c(H+)减小,平衡正向移动,生成的Fe(OH)3增多 2Fe3+ +SO![]() +H2O===2Fe2++SO
+H2O===2Fe2++SO![]() +2H+ FeSO3和FeCl3的混合溶液也可能出现“丁达尔效应” a H2SO3
+2H+ FeSO3和FeCl3的混合溶液也可能出现“丁达尔效应” a H2SO3![]() H++HSO
H++HSO![]() ;HSO
;HSO![]()
![]() H++SO
H++SO![]() ,SO
,SO![]() 与被还原生成的Fe2+结合为FeSO3,与剩余的FeCl3溶液混合而呈现红褐色
与被还原生成的Fe2+结合为FeSO3,与剩余的FeCl3溶液混合而呈现红褐色
【解析】
进行Na2SO3溶液与FeCl3溶液反应可能发生氧化还原反应或复分解反应的探究。从而分析出反应后红褐色产生的原因。
(1)氯化铁是强酸弱碱盐,铁离子水解溶液显酸性,因此常温下,FeCl3溶液的pH<7;
(2)①在氯化铁溶液中存在铁离子的水解平衡:Fe3++3H2O![]() Fe(OH)3+3H+,加入Na2SO3后,消耗氢离子,溶液中c(H+)下降,平衡正向移动,生成Fe(OH)3;
Fe(OH)3+3H+,加入Na2SO3后,消耗氢离子,溶液中c(H+)下降,平衡正向移动,生成Fe(OH)3;
②铁离子具有氧化性,亚硫酸钠具有还原性,二者可以发生氧化还原反应,结合得失电子守恒,其离子方程式为2Fe3++ SO32-+H2O==2Fe2++SO42-+2H+;
(3)由于FeSO3和FeCl3混合后即使不反应,混合溶液也可能出现“丁达尔效应”;
(4)①由于溶液显红褐色,虽然亚铁离子能与高锰酸钾溶液反应,但现象不明显,所以检验亚铁离子的试剂应该选择K3[Fe(CN)6] 溶液,实验现象是溶液中产生蓝色沉淀,答案选a。
②在溶液中铁离子与SO2发生氧化还原反应:2Fe3++ SO2+ 2H2O =2Fe2++ SO42-+ 4H+,生成的亚铁离子与SO2继续反应:Fe2++ SO2+H2O=FeSO3↓ + 2H+(或2Fe3++ 3SO2+ 4H2O =2FeSO3↓+ SO2- 4 + 8H+),生成的FeSO3与剩余的FeCl3溶液混合而呈现红褐色。