题目内容
19.已知25℃、101kPa下,下列反应C(石墨)+02(g)=C02(g),燃烧l mol C(石墨)放热393.51kJ.
C(金刚石)+02(g)=C02(g),燃烧1mol C(金刚石)放热395.41kJ.
可以得出的正确结论是( )
| A. | 金刚石比石墨更稳定 | B. | 石墨和金刚石都是碳的同位素 | ||
| C. | 金刚石转变为石墨是物理变化 | D. | 石墨的能量比金刚石低 |
分析 根据石墨、金刚石燃烧的热化学方程式,利用盖斯定律写出金刚石与石墨转化的热化学方程式,根据反应热比较金刚石与石墨的能量大小,能量越低越稳定.
解答 解:①C(石墨)+O2(g)=CO2(g)燃烧l mol C(石墨)放热393.51kJ即△H=-393.51kJ•mol-1
②C(金刚石)+O2(g)=CO2(g)燃烧1mol C(金刚石)放热395.41kJ即△H=-395.41kJ•mol-1,
①-②可得:C(石墨)=C(金刚石)△H=+1.9kJ•mol-1,
A、石墨转化为金刚石吸热,金刚石能量大于石墨的总能量,物质的量能量越大越不稳定,则石墨比金刚石稳定,故A错误;
B、金刚石和石墨是不同的单质,不属于碳的同位素,故B错误;
C、金刚石和石墨是不同的物质,石墨转化为金刚石是化学变化,故C错误;
D、石墨转化为金刚石吸热,金刚石能量大于石墨的总能量,所以石墨的能量比金刚石低,故D正确;
故选:D.
点评 本题考查了盖斯定律的应用,题目难度不大,注意物质的稳定性与能量大小的关系.

练习册系列答案
相关题目
9.乙醇分子中的各种化学键如图所示,下列关于乙醇在各种反应中断裂键的说明不正确的是( )
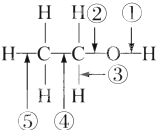

| A. | 和金属钠反应时①键断裂 | |
| B. | 在铜催化及加热条件下与O2反应时断裂①键和③键 | |
| C. | 在铜催化及加热条件下与O2反应时断裂①键和⑤键 | |
| D. | 在空气中完全燃烧时断裂①②③④⑤键 |
10.将两支盛有液态苯的试管分别插入95℃的水和4℃的水中,分别发现苯分别沸腾和凝固,以上事实说明( )
| A. | 苯的熔点比水的低、沸点比水的高 | B. | 苯的熔点比水的高、沸点比水的低 | ||
| C. | 苯的熔点、沸点都比水的高 | D. | 苯的熔点、沸点都比水的低 |
7.下列电子式或结构式错误的是( )
| A. | 氢氧根离子的电子式: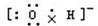 | B. | NH4Br的电子式: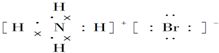 | ||
| C. | 四氯化碳的电子式: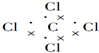 | D. | H2O的结构式:H-O-H |
4.下列有关实验操作和说法中,正确的是( )
| A. | 苯酚中滴加少量的稀溴水出现了1-溴苯酚的白色沉淀 | |
| B. | 检验C2H5Cl中氯原子时,将C2H5Cl和NaOH溶液混合加热后,加入稀硫酸酸化 | |
| C. | 用无水乙醇和浓H2SO4共热至140℃可以制得乙烯气体 | |
| D. | 制取溴苯应用液溴、铁屑和苯混合,反应后并用稀碱液洗涤 |
11.某烃与氢气发生反应后能生成(CH3)2CHCH2CH3,则该烃不可能是( )
| A. | 2-甲基-2-丁烯 | B. | 2,3-二甲基-1-丁烯 | ||
| C. | 3-甲基-1-丁烯 | D. | 2-甲基-1,3-丁二烯 |
8.下表是元素周期表的一部分,针对表中的①~⑩中10种元素用元素符号或化学式填空回答以下问题:
Ⅰ.填写下列空白:
(1)非金属性最强的元素是F(填元素符号),其离子结构示意图为 .
.
(2)写出②的氢化物的电子式: ,该氢化物的水溶液显碱性(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
,该氢化物的水溶液显碱性(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(3)最高价氧化物对应的水化物中碱性最强的是NaOH,写出该物质与⑦的最高价氧化物对应的水化物反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O
(4)写出由③⑤⑩三种元素组成、且暴露空气中易变质的化合物化学式:Na2SO3;该化合物含有化学键类型有:离子键、共价键;写出该物质暴露空气中变质的化学方程式:2Na2SO3+O2=2Na2SO4.
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生如图中的变化,其中A是一种淡黄色固体,可作供氧剂.X是一种氢化物,常温下为液体.则:
(1)写出A的晶体中存在的作用力有:共价键、离子键;
(2)气体Y是一种大气污染物,无色、有刺激性气味的,直接排放会形成酸雨.写出气体C与气体Y反应的化学方程式:2SO2+O2$?_{△}^{催化剂}$2SO3;
(3)在100mL 18mol/L的F浓溶液中加入过量铜片,加热使之充分反应,产生气体的体积为11.2L(标况下),则反应过程中转移的电子数为NA 或6.02×1023.
族 周期 | ⅠA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | VIIA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
(1)非金属性最强的元素是F(填元素符号),其离子结构示意图为
 .
.(2)写出②的氢化物的电子式:
 ,该氢化物的水溶液显碱性(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
,该氢化物的水溶液显碱性(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.(3)最高价氧化物对应的水化物中碱性最强的是NaOH,写出该物质与⑦的最高价氧化物对应的水化物反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O
(4)写出由③⑤⑩三种元素组成、且暴露空气中易变质的化合物化学式:Na2SO3;该化合物含有化学键类型有:离子键、共价键;写出该物质暴露空气中变质的化学方程式:2Na2SO3+O2=2Na2SO4.
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生如图中的变化,其中A是一种淡黄色固体,可作供氧剂.X是一种氢化物,常温下为液体.则:
(1)写出A的晶体中存在的作用力有:共价键、离子键;
(2)气体Y是一种大气污染物,无色、有刺激性气味的,直接排放会形成酸雨.写出气体C与气体Y反应的化学方程式:2SO2+O2$?_{△}^{催化剂}$2SO3;
(3)在100mL 18mol/L的F浓溶液中加入过量铜片,加热使之充分反应,产生气体的体积为11.2L(标况下),则反应过程中转移的电子数为NA 或6.02×1023.

9.1mol某烃在氧气中充分燃烧,需要消耗氧气179.2L(标准状况下).它在光照的条件下与氯气反应能生成3种不同的一氯取代物.该烃的结构简式是( )
| A. | 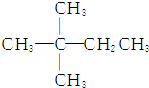 | B. | CH3CH2CH2CH2CH3 | ||
| C. | 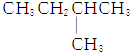 | D. | 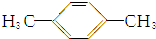 |
 ,可以证明该结论的实验是(用离子方程式表示)Cl2+S2-═2Cl-+S↓
,可以证明该结论的实验是(用离子方程式表示)Cl2+S2-═2Cl-+S↓