题目内容
2.在0.1mol•L-1的Na2CO3溶液中,下列关系正确的是( )| A. | c(Na+)=2c(CO32-) | B. | c(HCO3-)<c(H2CO3) | ||
| C. | c(Na+)<[c(CO32-)+c(HCO3-)] | D. | c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
分析 碳酸钠是强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,碳酸根离子第一步水解程度远远大于第二步,据此分析解答.
A、碳酸根离子水解减小;
B、碳酸根分步水解生成碳酸氢根离子;
C、依据溶液中物料守恒分析,n(Na)=2n(C);
D、溶液中存在质子守恒,水电离出的氢离子和氢氧根离子浓度相同.
解答 解:A.碳酸根离子水解而钠离子不水解,所以c(Na+)>2c(CO32-),故A错误;
B.碳酸根离子第一步水解远远大于第二步,所以c(HCO3-)>c(H2CO3),故B错误;
C.溶液中存在物料守恒c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),所以c(Na+)>c(CO32-)+c(HCO3-),故C错误;
D.碳酸根离子水解导致溶液呈碱性,碳酸根离子、碳酸氢根离子和水电离都生成氢氧根离子,只有水电离生成氢离子,所以溶液中存在质子守恒,即氢离子浓度的存在形式之和和氢氧根离子浓度相同,c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故D正确;
故选D.
点评 本题考查了离子浓度大小比较,任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒分析解答,注意碳酸根离子两步水解程度相对大小,题目难度不大.

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
13.下列电子式正确的是( )
| A. | H2O2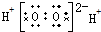 | B. | MgCl2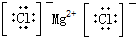 | C. | HClO  | D. | CCl4 |
17.关于实验室制乙炔的说法不正确的是( )
| A. | 因反应太剧烈,可用分液漏斗控制滴水速度来控制反应速度 | |
| B. | 为了得到比较平缓的乙炔气流,可用饱和食盐水代替水 | |
| C. | 乙炔气体中混有PH3和H2S等杂质,可用硫酸铜溶液将其除去 | |
| D. | 为控制反应的速率,可用碳化钙粉末和饱和食盐水反应 |
 利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.在有机物分子中,不同位置的氢原子的核磁共振谱中给出的峰值(信号)也不同.根据峰值(信号)可以确定有机物分子中氢原子的种类和数目.
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.在有机物分子中,不同位置的氢原子的核磁共振谱中给出的峰值(信号)也不同.根据峰值(信号)可以确定有机物分子中氢原子的种类和数目. ;若取一定量的B完全燃烧后,生成3mol CO2和1.5mol H2O,则有39g烃B参加了反应,燃烧时消耗氧气3.75mol.
;若取一定量的B完全燃烧后,生成3mol CO2和1.5mol H2O,则有39g烃B参加了反应,燃烧时消耗氧气3.75mol.