��Ŀ����
����Ŀ���������⡿������̼��һ�ֱ����̼����Դ����CO2��NH3Ϊԭ�Ϻϳ������ǹ̶�������CO2
�ijɹ������������غϳ����е���Ҫ��Ӧ�ɱ�ʾ���£�
��Ӧ I��2NH3(g)+CO2(g) ![]() NH2COONH4(s) ��H1=-159.47 kJ��mol-1
NH2COONH4(s) ��H1=-159.47 kJ��mol-1
��ӦII��NH2COONH4(s) ![]() CO(NH2)2(s)+H2O(g) ��H2=+72.49kJ��mol-1
CO(NH2)2(s)+H2O(g) ��H2=+72.49kJ��mol-1
��ش��������⣺
(l)д��CO2��NH3Ϊԭ���������غ���̬ˮ���Ȼ�ѧ��Ӧ����ʽ_______,��ӦII�Է����е�������_____��
(2)CO2��NH3Ϊԭ�Ϻϳ����صķ�Ӧ��Ӱ��CO2ת���ʵ����غܶ࣬��ͼΪij���������£���ͬˮ̼��[n(H2O)/n(CO2)]���¶�Ӱ��CO2ת���ʱ仯���������ߡ�

����˵������ȷ����__________��
A.�¶����{�÷�Ӧƽ�ⳣ����С�����߲�������ƽ�����������ƶ�
B.���¶ȵ���190��,���¶����{CO2ת������������ԭ��������¶�����ƽ�����������ƶ�
C.���¶��{��190������¶����{CO2ת������С����ԭ��������¶����߷����˸���Ӧ
D.����������ͬʱ��Ϊ���{CO2��ת���ʣ������п��Բ�ȡ�Ĵ�ʩ�����ˮ̼��
(3)ij�о�С��Ϊ̽����ӦI��Ӱ��C(CO2)�����أ��ں����½�0.4molNH3��0.2molCO2�����ݻ�Ϊ2L���ܱ������У�t1ʱ�ﵽƽ�⣬��c(CO2)��ʱ��t�仯������������ͼ��ʾ�������淴Ӧ��ƽ�ⳣ��Ϊ_____���������������䣬t1ʱ���������ѹ����1L,�뻭��t1t2ʱ���C(CO2)��ʱ��t�仯�������ߣ�t2ʱ�ﵽ�µ�ƽ�⣩��__________

(4)�������[CO(NH2)2]�ļ�����Һ��������װ��ʾ��ͼ����ͼ,��д����A�缫�Ϸ����ĵ缫��Ӧʽ_____��

���𰸡� 2NH3(g)��CO2(g) ![]() CO(NH2)2(s)��H2O(g) ��H=��86.98kJ��mol��1 ���� ABD 6.25��10-5
CO(NH2)2(s)��H2O(g) ��H=��86.98kJ��mol��1 ���� ABD 6.25��10-5 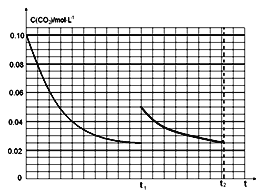 CO(NH2)2��8OH����6e��=N2����CO32-��6H2O
CO(NH2)2��8OH����6e��=N2����CO32-��6H2O
��������(l) ��Ӧ����2NH3(g)+CO2(g)NH2CO2NH4(s)��H1=-159.47 kJmol-1����Ӧ����NH2CO2NH4(s)CO(NH2)2(s)+H2O(g)��H2=+72.49kJmol-1�ɸ�˹�����ܷ�Ӧ��+��Ӧ�õ�2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)��H3=-86.98kJmol-1����Ӧ����NH2CO2NH4(s)CO(NH2)2(s)+H2O(g)��H2=+72.49kJmol-1����H��0����S��0��Ҫʹ����G=��H-T��S��0����T��Ҫ�ϴ��÷�ӦΪ�����Է����ʴ�Ϊ��2NH3(g)��CO2(g) ![]() CO(NH2)2(s)��H2O(g) ��H=��86.98kJ��mol��1�����£�
CO(NH2)2(s)��H2O(g) ��H=��86.98kJ��mol��1�����£�
(2)A. �ϳ����صķ�Ӧ�Ƿ��ȷ�Ӧ���¶����{��ƽ�������ƶ���ƽ�ⳣ����С������Ϊ���壬���߲�������ƽ�ⲻ�ƶ�����A����B. �ϳ����صķ�Ӧ�Ƿ��ȷ�Ӧ�����¶ȵ���190��,���¶����{��ƽ�������ƶ���CO2ת������С����B����C. �¶�Խ�ߣ���������Ӧ�Ŀ�����Խ�ߣ��ᵼ�¶�����̼ת���ʼ�С����C��ȷ��D.����ͼ��ˮ̼��Խ�ߣ�������̼��ת����Խ�ͣ���D����ѡABD��
(3)�ں����½�0.4mol NH3��0.2mol CO2�����ݻ�Ϊ2L���ܱ������У��ﵽƽ��ʱ��
2NH3(g)+CO2(g)NH2CO2NH4(s)
��ʼ��(mol/L) 0.2 0.1 0
�仯��(mol/L)0.15 0.075
ƽ����(mol/L)0.05 0.025
�淴Ӧ��ƽ�ⳣ��K=![]() =0.052��0.025=6.25��10-5��t1ʱ�ﵽƽ�������c(CO2)��ʱ��t�仯����������ͼ2��ʾ���������������䣬t1ʱ���������ѹ����1L��������̼Ũ��Ӧ����0.05mol/L��ѹǿ����ƽ��������У������������ǹ��壬���Դﵽƽ��״̬��������̼Ũ�ȱ��ֲ��䣬�ݴ˻����仯����Ϊ��
=0.052��0.025=6.25��10-5��t1ʱ�ﵽƽ�������c(CO2)��ʱ��t�仯����������ͼ2��ʾ���������������䣬t1ʱ���������ѹ����1L��������̼Ũ��Ӧ����0.05mol/L��ѹǿ����ƽ��������У������������ǹ��壬���Դﵽƽ��״̬��������̼Ũ�ȱ��ֲ��䣬�ݴ˻����仯����Ϊ�� ���ʴ�Ϊ��6.25��10-5��
���ʴ�Ϊ��6.25��10-5�� ��
��
(4)�õ�ط�Ӧʱ��CO(NH2)2+2OH-![]() CO32-+N2��+3H2������Ԫ�ػ��ϼ���-3�۱�Ϊ0�ۣ�HԪ�ػ��ϼ���+1�۱�Ϊ0�ۣ��������ɵ����ĵ缫�����������������ĵ缫����������A�缫�Ϸ����ĵ缫��ӦʽΪCO(NH2)2��8OH����6e��=N2����CO32-��6H2O���ʴ�Ϊ��CO(NH2)2��8OH����6e��=N2����CO32-��6H2O��
CO32-+N2��+3H2������Ԫ�ػ��ϼ���-3�۱�Ϊ0�ۣ�HԪ�ػ��ϼ���+1�۱�Ϊ0�ۣ��������ɵ����ĵ缫�����������������ĵ缫����������A�缫�Ϸ����ĵ缫��ӦʽΪCO(NH2)2��8OH����6e��=N2����CO32-��6H2O���ʴ�Ϊ��CO(NH2)2��8OH����6e��=N2����CO32-��6H2O��



