题目内容
【题目】将 Na2SO4、MgSO4、H2SO4 溶于水配成 0.2 L 混合溶液,部分离子浓度如图 所示,下列说法错误的( )
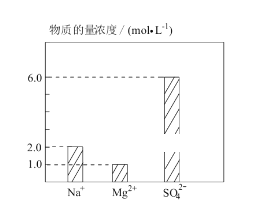
A. 该混合溶液中 Na2SO4 的物质的量为 0.2 mol
B. 该混合溶液中 H+的物质的量浓度为 8mol·L-1
C. 若将该混合溶液加水稀释至体积为 1 L,稀释后溶液中SO42-的物质的量浓度为 1.2 mol·L-1
D. 若向该混合溶液中逐滴加入 2 mol·L-1NaOH 溶液至Mg2+恰好完全沉淀,需 NaOH 溶液 200 mL
【答案】D
【解析】
A.由图示可知,该混合溶液中Na+的物质的量浓度为2 mol·L-1,则Na+的物质的量为0.4 mol,该混合溶液中 Na2SO4 的物质的量为 0.2 mol,故A正确;
B.根据电荷守恒得,c(Na+)+2 c(Mg2+)+ c(H+)=2 c(SO42-),代入数据2 mol·L-1+2×1 mol·L-1+ c(H+)=2×6 mol·L-1,解得c(H+)=8mol·L-1,故B正确;
C. 若将该混合溶液加水稀释至体积为 1 L,, 稀释后溶液中SO42-的物质的量浓度为6 mol·L-1×0.2 L/1L=1.2 mol·L-1,故C正确;
D.混合溶液H+的物质的量为8mol·L-1×0.2 L=1.6mol,Mg2+的物质的量为0.2mol,若向混合溶液中逐滴加入 2 mol·L-1NaOH溶液,NaOH先中和H+,当Mg2+恰好完全沉淀时,需NaOH的物质的量为1.6mol+0.4mol=2mol,则需NaOH溶液的体积为2mol/2mol·L-1=1L=1000mL,故D错误。
故选D。

练习册系列答案
相关题目