题目内容
【题目】已知X,Y,Z,E,F五种常见物质含有同一元素M,在一定条件下它们有如图转化关系,Z是NO,下列推断不合理的是( ) 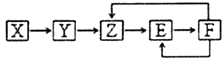
A.X可能是一种氢化物
B.X生成Z一定是化合反应
C.E可能是一种有色气体
D.F中M元素的化合价可能为+5
【答案】B
【解析】解:A.如果X是水,分解可生成O2 , O2与N2反应生成NO,X可能是一种氢化物,故A正确;
B.Z为NO,如果Y是O2 , 那么NH3与O2在催化剂的条件下可以生成NO,所以不一定就是化合反应,故B错误;
C.因为Z是NO,所以E可能是NO2(红棕色),故C正确;
D.F可以是HNO3 , M元素的化合价可能为+5,故D正确.
故选B.
已知X、Y、Z、E、F五种常见物质含有同一元素M,在一定条件下它们有如图转化关系,Z是NO,E为NO2 , F为HNO3 , 推断Y为O2或N2或NH3;X可能为H2O、NH3、N2等.

【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t ℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_________________________________。
(2)该反应为________反应(填“吸热”或“放热”)。
(3)某温度下,各物质的平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为______。
(4)若830 ℃时,向容器中充入1 mol CO、5 mol H2O,反应达到平衡后,其化学平衡常数K______1.0(填“大于”“小于”或“等于”)。
(5)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡____移动(填“向正反应方向”“向逆反应方向”或“不”)。
(6)若1 200 ℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为__________(填“正反应方向”“逆反应方向”或“不移动”)。
【题目】下列是部分短周期中第二、第三周期元素的原子半径及主要化合价.
元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.153 | 0.110 | 0.099 | 0.075 | 0.074 |
主要化合价 | +1 | +2 | +1 | +3 | +5、 | +7、 | +5、 | ﹣2 |
回答下列问题:
(1)写出它们的元素名称:①②③④⑤⑥⑦⑧
(2)⑧在元素周期表中的位置是(周期、族)
(3)8个元素的最高价氧化物的水化物中,酸性最强的是(填化学式).
(4)①元素和⑥元素形成化合物的电子式是 .
(5)写出④最高价氧化物对应水化物与⑥的氢化物水溶液反应的离子方程式: .
(6)下列叙述正确的是(填字母). A.③、④处于不同周期
B.②的阳离子与⑧的阴离子的核外电子数相等
C.⑥在同主族元素中非金属性最强
D.⑤元素与⑦元素两者核电荷数之差是8
E.①与⑧形成的化合物具有两性.