��Ŀ����
����Ŀ�������Dz��ֶ������еڶ�����������Ԫ�ص�ԭ�Ӱ뾶����Ҫ���ϼۣ�
Ԫ�ش��� | �� | �� | �� | �� | �� | �� | �� | �� |
ԭ�Ӱ뾶��nm�� | 0.186 | 0.160 | 0.152 | 0.153 | 0.110 | 0.099 | 0.075 | 0.074 |
��Ҫ���ϼ� | +1 | +2 | +1 | +3 | +5�� | +7�� | +5�� | ��2 |
�ش��������⣺
��1��д�����ǵ�Ԫ�����ƣ�����������������
��2������Ԫ�����ڱ��е�λ���ǣ����ڡ��壩
��3��8��Ԫ�ص�����������ˮ�����У�������ǿ�������ѧʽ����
��4����Ԫ�غ͢�Ԫ���γɻ�����ĵ���ʽ�� ��
��5��д��������������Ӧˮ��������⻯��ˮ��Һ��Ӧ�����ӷ���ʽ�� ��
��6������������ȷ����������ĸ���� A���ۡ��ܴ��ڲ�ͬ����
B���ڵ����������������ӵĺ�����������
C������ͬ����Ԫ���зǽ�������ǿ
D����Ԫ�����Ԫ�����ߺ˵����֮����8
E��������γɵĻ�����������ԣ�
���𰸡�
��1��Na��Mg��Li��Al��P��Cl��N��O
��2���ڶ�����VIA��
��3��HClO4
��4��![]()
��5��Al��OH��3+3H+=Al3++3H2O
��6��A��B��D
���������⣺��1���ڶ���������Ԫ���У��٢۾���+1�ۣ�����IA�壬ԭ�Ӱ뾶�٣��ۣ����ΪNa����ΪLi���ݢ߾���+5����3�ۣ�ԭ�Ӱ뾶�ݣ��ߣ����ΪPԪ�ء���ΪNԪ�أ�����+2�ۣ����ڢ�A�壬ԭ�Ӱ뾶����P���ʢ�ΪMg������+3�ۣ����ڢ�A�壬ԭ�Ӱ뾶����P���ʢ�ΪAl������+7����1�ۣ����ΪCl�����Щ�2�ۣ�����VIA�壬ԭ�Ӱ뾶С���ȣ��ʢ�ΪOԪ�أ� ���Դ��ǣ�Na��Mg��Li��Al��P��Cl��N��O����2����ΪOԪ�أ���Ԫ�����ڱ��е�λ���ǣ��ڶ�����VIA�壬
���Դ��ǣ��ڶ�����VIA�壻��3��8��Ԫ�ص�����������ˮ�����У�������ǿ����HClO4 ��
���Դ��ǣ�HClO4����4����Ԫ�غ͢�Ԫ���γɻ�����ΪNaCl������ʽ�� ![]() ��
��
���Դ��ǣ� ![]() ����5��������������Ӧˮ����ΪAl��OH��3 �� ���⻯��ˮ��ҺΪ���ᣬ���߷�Ӧ�����ӷ���ʽ��Al��OH��3+3H+=Al3++3H2O��
����5��������������Ӧˮ����ΪAl��OH��3 �� ���⻯��ˮ��ҺΪ���ᣬ���߷�Ӧ�����ӷ���ʽ��Al��OH��3+3H+=Al3++3H2O��
���Դ��ǣ�Al��OH��3+3H+=Al3++3H2O����6��A����ΪLi�����ڵڶ����ڣ���ΪAl�����ڵ������ڣ���A��ȷ��
B���ڵ������Ӻ��������Ϊ10����������ӵĺ��������Ϊ10����B��ȷ��
C����ͬ����Ԫ����FԪ�طǽ����Ա�Cl��ǿ����C����
D����ΪPԪ�ء���ΪNԪ�أ����ߺ˵����֮����8����D��ȷ��
E��������γɵĻ�����Ϊ�����ơ��������ƣ����������������E����
��ѡ��ABD��

 ��ڽ��ȫ������ϵ�д�
��ڽ��ȫ������ϵ�д�����Ŀ��һ���¶��£���10 mL 0.40 mol��L-1 H2O2��Һ�м�������FeCl3��Һ����ͬʱ�̲������O2�������������Ϊ��״�������±���ʾ��
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
������ʾ����Ӧ���������У�
��2Fe3++ H2O2 ![]() 2Fe2++O2��+2H+
2Fe2++O2��+2H+
�� H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
��Ӧ�����������仯����ͼ��ʾ������˵������ȷ����
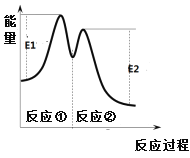
A. 0��6 min��ƽ����Ӧ���ʣ�v(H2O2) = 3.33��10-2 mol��L-1��min-1
B. Fe3+�������Ǽӿ��������ķֽ�����
C. ��Ӧ�������ȷ�Ӧ����Ӧ���Ƿ��ȷ�Ӧ
D. ��Ӧ2H2O2(aq)![]() 2H2O(l) + O2(g)�ġ�H =E1-E2 < 0
2H2O(l) + O2(g)�ġ�H =E1-E2 < 0