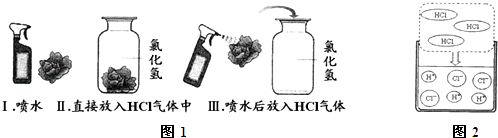
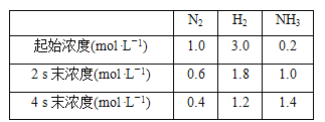
题目内容
【题目】氮、磷、砷、硼的相关化合物在化工、医药、农药、材料等领域有着广泛的应用。回答下列问题:
(1)基态As原子的电子排布式为__________。N、P、As的第一电离能的大小顺序为 _______。
(2)氮化硼(BN)有多种晶体,其中立方氮化硼与金刚石的构型类似,则其晶胞中B-N-B之间的夹角是_________(填角度)。
(3)砷化硼(BAs)是Ⅲ-V族半导体材料的重要成员之一,其晶体结构与金刚石相似。
①BAs晶体中,每个As与_____个B相连,As的杂化形式为______;
②已知B原子的电负性比As原子的电负性大,则As与B之间存在的化学键有_______(填字母)。
A.离子键 B. 金属键 C.极性键 D.氢键 E.配位键F.![]() 键G.
键G. ![]() 键
键
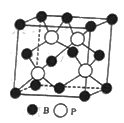
(4)磷化硼(BP)是一种有价值的耐磨硬涂层材料,这种陶瓷材料可作为金属表面的保护薄膜,它是通过在高温(T>750℃)氢气氛围下BBr3和PBr3反应制得的,BBr3的空间构型为______,BP晶胞的结构如图所示,当晶胞晶格参数为478pm(即图中立方体的每条边长为478pm)时,BP中B和P之间的最近距离为_____。
【答案】 1s22s22p63s23p63d104s24p3 N>P>As 109°28′ 4 sp3杂化 CEF 平面三角形 119.5![]() pm
pm
【解析】(1)As是33号元素,其核外电子排布为,1s22s22p63s23p63d104s24p3;非金属性越强,第一电离能越大,N>P>As;(2)立方氮化硼与金刚石的构型类似,金刚石为正四面体结构,键角为109°28′,则其晶胞中B﹣N﹣B之间的夹角是109°28′;(3)①砷化硼(BAs)晶体结构与金刚石相似,为正四面体结构,则每个As与4个B相连,BAs的电子对有![]() =4对,中心原子As的杂化形式为sp3杂化;②硼原子可以形成3个硼硼单键,所以每个As应与3个B相连,金刚石中含有的化学键是共价键,所以该物质中含有的化学键是极性键,单键为
=4对,中心原子As的杂化形式为sp3杂化;②硼原子可以形成3个硼硼单键,所以每个As应与3个B相连,金刚石中含有的化学键是共价键,所以该物质中含有的化学键是极性键,单键为![]() 键,又因为砷原子还有1对孤对电子,而硼原子有容纳孤对电子的空轨道,所以还可以构成配位键。答案选CEF;(4)B原子含有3个价电子,与3个Br原子形成σ键,空间构型为平面三角形;根据BP的晶胞示意图可知硼原子和磷原子之间的最近距离等于晶胞体对角线的
键,又因为砷原子还有1对孤对电子,而硼原子有容纳孤对电子的空轨道,所以还可以构成配位键。答案选CEF;(4)B原子含有3个价电子,与3个Br原子形成σ键,空间构型为平面三角形;根据BP的晶胞示意图可知硼原子和磷原子之间的最近距离等于晶胞体对角线的![]() ,设最近距离为x,则(4x)2=4782+4782+4782,解得x=
,设最近距离为x,则(4x)2=4782+4782+4782,解得x=![]() pm=119.5
pm=119.5![]() pm。
pm。

【题目】烯烃的甲酰化反应实例之一是CH3CH=CH2与CO、H2在催化剂作用下可合成正丁醛(CH3 CH2 CH2 CHO),有关反应如下:
①CH3CH=CH2(g)+CO (g)+H2(g)![]() CH3CH2CH2CHO(g) ΔH1
CH3CH2CH2CHO(g) ΔH1
副反应有:
②CH3CH=CH2(g)+ CO (g)+ H2(g)![]() (CH3)2CHCHO(g) ΔH2
(CH3)2CHCHO(g) ΔH2
③CH3CH=CH2(g)+ H2(g) → CH3 CH2 CH3(g) ΔH3
回答下列问题:
(1)不考虑副反应,则从绿色化学角度考虑,烯烃甲酰化反应的主要优点是_______________________________。
(2)已知下列键能数据:
化学键 | C-H | C-C | C=C | H-H |
键能/KJ·mol-1 | 413.3 | 347.7 | 615.0 | 436.0 |
则反应CH3CH=CH2(g)+ H2(g) → CH3 CH2 CH3(g)的ΔH3=_______________。
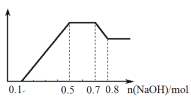
(3)在恒容密闭容器中充入1 mol丙烯,加入某种催化剂在加热条件下进行反应,测得温度与丙烯的总平衡转化率及两种异构体的物质的量之比的关系如下图所示:
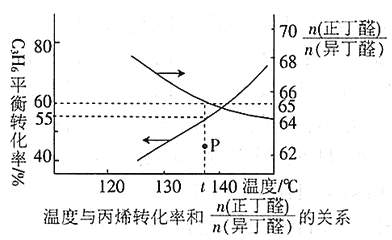
①丙烯合成正丁醛(CH3 CH2 CH2 CHO)及异丁醛((CH3)2CHCHO)的反应属于______________(填“吸热”或“放热”)反应。
②t℃时,反应(CH3)2CHCHO(g)![]() CH3 CH2 CH2 CHO(g)的平衡常数K =____________________,若发生上述反应①②,则反应达到平衡时,容器中正丁醛的物质的量为_______。
CH3 CH2 CH2 CHO(g)的平衡常数K =____________________,若发生上述反应①②,则反应达到平衡时,容器中正丁醛的物质的量为_______。
③t℃时,图中P点的反应速率v(正)_______v(逆)(填“<” “>”或“=”)。
④要提高正丁醛的产率除采用合适的温度外,还可_______________________。