题目内容
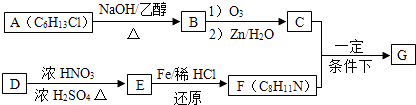
【题目】现有7种物质:①干冰②金刚石③四氢化碳④晶体硅⑤过氧化钠⑥二氧化硅晶体⑦氯化铵(用序号回答)
(1)这些物质中熔点最高的是
(2)属于分子晶体的是 , 其中分子构型为正四面体的是 , 杂化类型为 .
(3)属于离子晶体的是
(4)写出含有极性键和配位键的离子化合物的电子式 .
【答案】
(1)②
(2)①③;③;sp3
(3)⑤⑦
(4)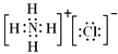
【解析】解:(1)干冰、四氢化碳常温下为气体,其晶体为分子晶体;氯过氧化钠、氯化铵为离子晶体;金刚石、二氧化硅晶体、晶体硅为原子晶体,金刚石是由C﹣C键形成,二氧化硅由Si﹣O键形成,硅单质由Si﹣Si键形成,其中C﹣C键键长最短,键能最大,所以熔点最高的是金刚石,所以答案是:②;(2)干冰、四氢化碳都是由分子构成的分子晶体,其中干冰为直线型分子,四氢化碳中心原子C电子对数为 ![]() =4,杂化方式为sp3 , 孤电子对数为0,分子构型为正四面体,所以答案是:①③;③;sp3;(3)过氧化钠、氯化铵都是由离子构成的离子晶体,所以答案是:⑤⑦;(4)NH4Cl中阴阳离子之间形成离子键,铵根离子中含有极性键和配位键;所以既含有离子键,又含有极性键和配位键的离子晶体是NH4Cl,其电子式为
=4,杂化方式为sp3 , 孤电子对数为0,分子构型为正四面体,所以答案是:①③;③;sp3;(3)过氧化钠、氯化铵都是由离子构成的离子晶体,所以答案是:⑤⑦;(4)NH4Cl中阴阳离子之间形成离子键,铵根离子中含有极性键和配位键;所以既含有离子键,又含有极性键和配位键的离子晶体是NH4Cl,其电子式为 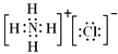 ,所以答案是:
,所以答案是: 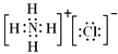 .
.

练习册系列答案
相关题目