题目内容
有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相
同(选项中m、n均为正整数)。下列说法正确的是( )
| A.若X(OH)n为强碱,则Y(OH)n也一定为强碱 |
| B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性 |
| C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2 |
| D.若Y的最高正价为+ m,则X的最高正价一定为+ m |
A
解析试题分析:X、Y原子的最外层电子数相同,说明X、Y同主族,X的原子半径小于Y,说明X在Y的上方。A、若X(OH)n为强碱,则Y的金属性一定比X强,所以Y(OH)n也一定为强碱,正确;B、若HnXOm为强酸,说明X的非金属性强,但X的氢化物溶于水不一定显酸性,如N元素的氢化物的水溶液显碱性,错误;C、若X元素形成的单质是X2,则Y元素形成的单质不一定是Y2,如X是O元素,则Y是S元素,S的单质有多种同素异形体,错误;D、若Y的最高正价为+ m,则X的最高正价不一定为+m,如Cl的最高正价为+7,但F无正价,错误,答案选A。
考点:考查同主族元素性质的相似性和递变性

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是( ) 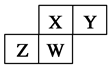
| A.原子半径:W>Z>Y>X |
| B.气态氢化物的稳定性:Z>W>X>Y |
| C.W的最高正化合价与负化合价的绝对值可能相等 |
| D.Z的最高价氧化物的水化物可能为强碱 |
甲、乙、丙、丁4种无机化合物均含有2种元素,分子中均含18个电子。甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是
| A.某钠盐溶液含甲电离出的阴离子…则该溶液显碱性,只能与酸反应 |
| B.乙和甲中同种元素的质量分数相等,则乙能使湿润的KI淀粉试纸变蓝 |
| C.丙中含有ⅣA族元素,则相同条件下丙比甲稳定 |
| D.若丁的分子组成符合XY3型结构,则丁分子间存在氢键 |
元素在周围表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
| A.同一元素不可能既表现金属性,又表现非金属性 |
| B.第三周期主族元素的最高正化合价等于它所处的主族序数 |
| C.短周期元素形成离子后,最外层都达到8电子稳定结构 |
| D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
某电荷数小于18的元素X,其原子核外电子层数为a,最外层电子数为(2a+1)。下列有关元素X的说法中,不正确的是 ( )
| A.元素X的原子核内质子数为(2a2-1) |
| B.元素X形成的单质既能作氧化剂又能作还原剂 |
| C.元素X形成的简单离子,各电子层的电子数均达到2n2个(n表示电子层数) |
| D.由元素X形成的某些化合物,可能具有杀菌消毒的作用 |
下列事实中,能说明氯的非金属性比硫强的是
| A.高氯酸的酸性比亚硫酸强 | B.次氯酸的氧化性比稀硫酸强 |
| C.氯化氢比硫化氢的热稳定性好 | D.氯原子最外层电子数比硫原子多 |
硼有两种天然同位素10B和11B,硼元素的相对原子质量为10.8,则10B与11B的物质的量之比为( )
| A.1∶4 | B.1∶2 | C.1∶1 | D.1∶3 |
根据下表(部分短周期元素的原子半径及主要化合价)信息,判断以下叙述正确的是
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
A.最高价氧化物对应水化物的碱性A>C
B.氢化物的沸点H2D>H2E
C.单质与稀盐酸反应的速率A<B
D.C2+与A+的核外电子数相等
下列说法正确的是( )
| A.第ⅥA族元素从上到下,其氢化物的稳定性逐渐减弱 |
| B.L层电子数为奇数的所有元素都是非金属元素 |
| C.ⅦA族元素阴离子的还原性越强,元素的最高价氧化物对应水化物的酸性也越强 |
| D.同一主族的甲乙两种元素,甲的原子序数为a,则乙的原子序数可能为a+4 |