题目内容
19.下列离子方程式不正确的是( )| A. | 向烧碱液中通入过量的二氧化碳:2OH-+CO2═CO32-+H2O | |
| B. | 向纯碱溶液通入足量的二氧化碳:CO32-+CO2+H2O═2HCO3- | |
| C. | 向硅酸钠水液中通人少量的二氧化碳:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| D. | 向次氯酸钠溶液中通人少量的二氧化碳:ClO-+CO2+H2O═HClO+HCO3- |
分析 A.二者反应生成碳酸氢钠;
B.二者反应生成碳酸氢钠;
C.硅酸钠中加入少量二氧化碳,二者反应生成硅酸和碳酸钠;
D.次氯酸中通入少量二氧化碳,二者反应生成次氯酸和碳酸氢钠.
解答 解:A.二者反应生成碳酸氢钠,离子方程式为OH-+CO2═HCO3-,故A错误;
B.二者反应生成碳酸氢钠,离子方程式为CO32-+CO2+H2O═2HCO3-,故B正确;
C.硅酸钠中加入少量二氧化碳,二者反应生成硅酸和碳酸钠,离子方程式为SiO32-+CO2+H2O═H2SiO3↓+CO32-,故C正确;
D.次氯酸中通入少量二氧化碳,二者反应生成次氯酸和碳酸氢钠,离子方程式为:ClO-+CO2+H2O═HClO+HCO3-,故D正确;
故选A.
点评 本题考查离子方程式正误判断,为高频考点,明确生成物成分是解本题关键,注意:AC生成物成分与反应物的量有关,反应物的量不同其产物不同,注意D中次氯酸酸性小于碳酸但大于碳酸氢根离子,为易错点.

练习册系列答案
相关题目
9.下列有关钠及其化合物的说法,错误的是( )
| A. | 过氧化钠可用作漂白剂和呼吸面具中的供氧剂 | |
| B. | 钠和钾的合金常温下是固体,可用于快中子反应堆作热交换剂 | |
| C. | 碳酸氢钠是焙制糕点所用的发酵粉之一,也可以用于治疗胃酸过多 | |
| D. | 热的碳酸钠溶液可以去除物品表面的油污 |
10.已知m mol某气体的质量为a g,则 b g该气体在标准状况下的体积(L)为( )
| A. | 22.4am/b | B. | 22.4b/am | C. | 22.4bm/a | D. | 22.4a/bm |
14.下列离子方程式中书写正确的是( )
| A. | Fe跟FeCl3溶液反应:Fe+Fe3+═2Fe2+ | |
| B. | Fe跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | FeCl3与Cl2反应:Fe2++Cl2═Fe3++2Cl- | |
| D. | Fe(OH)3跟硝酸反应:Fe(OH)3+3H+═Fe3++3H2O |
4.下列有机物中不属于醇类的是( )
| A. | 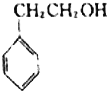 | B. | 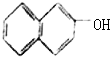 | C. |  | D. |  |
6.在T℃时,向1L固定体积的密闭容器M中加入2mol X和1mol Y,发生如下反应:2X(g)+Y(g)?aZ(g)+W(g)△H=-Q kJ/mol(Q>0);该反应达到平衡后,放出的热量为Q1kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小.
请回答下列问题:
(1)化学计量数a的值为1.
(2)下列能说明该反应达到了化学平衡状态的是ac(填序号).
a.容器内气体的压强一定b.容器内气体的密度一定
c.容器内Z的分子数一定d.容器内气体的质量一定
(3)维持T℃温度不变,若起始时向容器M中加入2mol X、1mol Y和1mol Ar(稀有气体不参与反应),则反应达到平衡后放出的热量是Q1kJ.若起始时向容器M中加入4mol X和6mol Y,反应达到平衡时容器内的分子数目减少10%,则反应中放出的热量为QkJ.
(4)维持T℃温度不变,若在一个和原容器体积相等的恒压容器N中加入2mol X和1mol Y,发生题给反应并达到平衡,则N(填“M”或“N”)容器中的反应先达到平衡状态,容器中X的质量分数M>N(填“>”、“<”或“=”).
(5)已知:该反应的平衡常数随温度的变化情况如表所示:
若在某温度下,2mol X和1mol Y在容器M中反应并达到平衡,X的平衡转化率为50%,则该温度为350℃.
请回答下列问题:
(1)化学计量数a的值为1.
(2)下列能说明该反应达到了化学平衡状态的是ac(填序号).
a.容器内气体的压强一定b.容器内气体的密度一定
c.容器内Z的分子数一定d.容器内气体的质量一定
(3)维持T℃温度不变,若起始时向容器M中加入2mol X、1mol Y和1mol Ar(稀有气体不参与反应),则反应达到平衡后放出的热量是Q1kJ.若起始时向容器M中加入4mol X和6mol Y,反应达到平衡时容器内的分子数目减少10%,则反应中放出的热量为QkJ.
(4)维持T℃温度不变,若在一个和原容器体积相等的恒压容器N中加入2mol X和1mol Y,发生题给反应并达到平衡,则N(填“M”或“N”)容器中的反应先达到平衡状态,容器中X的质量分数M>N(填“>”、“<”或“=”).
(5)已知:该反应的平衡常数随温度的变化情况如表所示:
| 温度/℃ | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 |