题目内容
3.在2L的恒容容器中,将2molN2和8mol H2在适宜条件下按下式进行反应:N2+3H2?2NH3,当在某一温度下达到化学平衡状态,此时生成氨气2mol.(1)求N2的转化率?
(2)求化学平衡常数?
分析 利用三段式分析
N2 +3H2 ?2NH3,
开始(mol):2 8 0
变化(mol):1 3 2
平衡(mol):1 5 2
(1)根据转化率=$\frac{已转化的物质的量}{起始的物质的量}$×100%;
(2)根据c=$\frac{n}{V}$,计算得平衡时各物质的浓度,再根据K=$\frac{{c}^{2}(NH{\;}_{3})}{c(N{\;}_{2}){c}^{3}({H}_{2})}$计算;
解答 解:利用三段式分析
N2 +3H2?2NH3,
开始(mol):2 8 0
变化(mol):1 3 2
平衡(mol):1 5 2
(1)N2的转化率=$\frac{1}{2}$×100%=50%,
答:N2的转化率为50%;
(2)根据c=$\frac{n}{V}$可知,平衡时c(N2)=$\frac{1mol}{2L}$=0.5mol/L,c(H2)=$\frac{5mol}{2L}$=2.5mol/L,c(NH3)=$\frac{2mol}{2L}$=1mol/L,所以平衡常数K=$\frac{{c}^{2}(NH{\;}_{3})}{c(N{\;}_{2}){c}^{3}({H}_{2})}$=$\frac{{1}^{2}}{2.{5}^{3}×0.5}$=0.128,
答:化学平衡常数为0.128,
点评 本题考查化学平衡的有关计算,题目难度不大,注意把握有关计算公式的运用和对概念的理解.

练习册系列答案
相关题目
18.新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化.某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如图,下列说法正确的是( )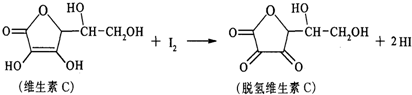

| A. | 上述反应为取代反应 | |
| B. | 维生素C能使高锰酸钾酸性溶液褪色 | |
| C. | 维生素C不溶于水,可溶于有机溶剂 | |
| D. | 维生素C的分子式为C6H10O6 |
19.下列离子方程式不正确的是( )
| A. | 向烧碱液中通入过量的二氧化碳:2OH-+CO2═CO32-+H2O | |
| B. | 向纯碱溶液通入足量的二氧化碳:CO32-+CO2+H2O═2HCO3- | |
| C. | 向硅酸钠水液中通人少量的二氧化碳:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| D. | 向次氯酸钠溶液中通人少量的二氧化碳:ClO-+CO2+H2O═HClO+HCO3- |
8.起.下列关于沉淀溶解平衡说法正确的是( )
| A. | 易溶盐不存在沉淀溶解平衡 | |
| B. | 可通过调节溶液pH或加入沉淀剂使某些金属离子沉淀 | |
| C. | 某离子在溶液中沉淀完全,则该离子在溶液中已不存在 | |
| D. | 一般,溶解度小的易转化成溶解度更小的,而溶解度更小的不能转化成溶解度小的 |
15.将30mL 0.5mol/L的NaOH溶液加水稀释到500mL,稀释后NaOH的物质的量浓度为( )
| A. | 0.3 mol/L | B. | 0.03 mol/L | C. | 0.05 mol/L | D. | 0.04 mol/L |
12.现有易溶于水的五种物质A、B、C、D、E,其中有一种是碱,四种是盐,溶于水后电离可以产生下表中的离子:
为鉴别它们,分别完成以下实验,其结果如下:
①A溶液与B溶液反应生成无色气体x,x可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
②B溶液与C溶液反应生成自色沉淀D,沉淀D不溶于稀硝酸.
请根据上述实验结果,填空:
(1)写出下列物质的化学式:XCO2,CBa(OH)2,BNaHSO4
(2)完成A溶液与X 气体反应的离子方程式:CO32-+H2O+CO2=2HCO3-
(3)D 与E的混介物ag,加入足量盐酸,反应完毕生成标准状况时的气体bL,则D在混合物中的质量分数为1-$\frac{197b}{22.4a}$×100%.
(4)已知NaHCO3溶液呈碱性.B 溶液与A 溶液反应至恰好溶液呈中性,写出该过程的离子反应方程式2H++CO32-=H2O+CO2↑.
| 阳离子 | Na+ H+ Ba2+ |
| 阴离子 | OH- CO32- SO42- |
①A溶液与B溶液反应生成无色气体x,x可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
②B溶液与C溶液反应生成自色沉淀D,沉淀D不溶于稀硝酸.
请根据上述实验结果,填空:
(1)写出下列物质的化学式:XCO2,CBa(OH)2,BNaHSO4
(2)完成A溶液与X 气体反应的离子方程式:CO32-+H2O+CO2=2HCO3-
(3)D 与E的混介物ag,加入足量盐酸,反应完毕生成标准状况时的气体bL,则D在混合物中的质量分数为1-$\frac{197b}{22.4a}$×100%.
(4)已知NaHCO3溶液呈碱性.B 溶液与A 溶液反应至恰好溶液呈中性,写出该过程的离子反应方程式2H++CO32-=H2O+CO2↑.
13.下列说法不正确的是( )
| A. | 常温下,可以用铁、铝制的容器来盛装浓硫酸或浓硝酸 | |
| B. | 实验室中,盛装NaOH溶液的试剂瓶用橡皮塞 | |
| C. | 实验室中,可以用量筒、滴定管、容量瓶准确量取一定体积的液体用于化学反应等 | |
| D. | 实验室中,盛放氢氟酸不能用玻璃瓶 |
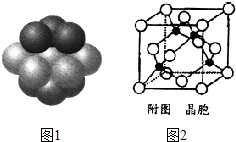 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题: