题目内容
6.在T℃时,向1L固定体积的密闭容器M中加入2mol X和1mol Y,发生如下反应:2X(g)+Y(g)?aZ(g)+W(g)△H=-Q kJ/mol(Q>0);该反应达到平衡后,放出的热量为Q1kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小.请回答下列问题:
(1)化学计量数a的值为1.
(2)下列能说明该反应达到了化学平衡状态的是ac(填序号).
a.容器内气体的压强一定b.容器内气体的密度一定
c.容器内Z的分子数一定d.容器内气体的质量一定
(3)维持T℃温度不变,若起始时向容器M中加入2mol X、1mol Y和1mol Ar(稀有气体不参与反应),则反应达到平衡后放出的热量是Q1kJ.若起始时向容器M中加入4mol X和6mol Y,反应达到平衡时容器内的分子数目减少10%,则反应中放出的热量为QkJ.
(4)维持T℃温度不变,若在一个和原容器体积相等的恒压容器N中加入2mol X和1mol Y,发生题给反应并达到平衡,则N(填“M”或“N”)容器中的反应先达到平衡状态,容器中X的质量分数M>N(填“>”、“<”或“=”).
(5)已知:该反应的平衡常数随温度的变化情况如表所示:
| 温度/℃ | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
分析 (1)该反应是一个放热反应,升高温度平衡向逆反应方向移动,混合气体的平均相对分子质量减小,则气体反应物计量数之和大于气体生成物计量数之和;
(2)当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,由此衍生的一些物理性不变,以此解答该题;
(3)反应物的浓度不变,则其转化率不变,放出的热量不变;根据减少的分子数计算参加反应的X的物质的量,根据X和反应热之间的关系式计算;
(4)该条件下,恒压与恒容相比,相当于增大压强,增大压强平衡向正反应方向移动,压强越大,反应速率越大,据此判断到达平衡时间,根据平衡移动方向判断X的质量分数;
(5)计算该温度下的平衡常数,根据表格中平衡常数和温度的关系判断;
解答 解:(1)该反应是一个放热反应,升高温度平衡向逆反应方向移动,混合气体的平均相对分子质量减小,则气体反应物计量数之和大于气体生成物计量数之和,所以a=1,
故答案为:1;
(2)a、由于反应前后气体的化学计量数之和不相等,则平衡时压强不再发生变化,故a正确;
b、由于是在固定体积的容器中反应,则无论是否达到平衡状态,密度都不变,故b错误;
c、反应达到平衡状态时,物质的浓度、含量、质量等不再发生变化,则平衡时容器内Z分子数一定,故c正确;
d、反应物和生成物都是气体,无论是否达到平衡状态,容器内气体的质量都一定,故d错误.
故答案为:ac;
(3)若起始时向容器M中加入2mol X、1mol Y和1mol Ar(稀有气体不参与反应),X和Y的浓度不变,所以其转化率不变,该反应达到平衡状态时,放出的热量不变为Q1,同一容器中,物质的分子数之比等于物质的量之比,当反应达到平衡时容器内的分子数目减少10%时,气体的物质的量减少10%,即气体的物质的量减少(4+6)mol×10%=1mol,根据2X(g)+Y(g) ?Z(g)+W(g)知,当气体的物质的量减少1mol时参加反应的X的物质的量是2mol,则反应中放出的热量为QkJ,故答案为:Q1;Q;
?Z(g)+W(g)知,当气体的物质的量减少1mol时参加反应的X的物质的量是2mol,则反应中放出的热量为QkJ,故答案为:Q1;Q;
(4)该条件下,恒压与恒容相比,相当于增大压强,压强越大,反应速率越大,反应到达平衡的时间越短,增大压强平衡向正反应方向移动,则X的质量发生越小,
故答案为:N;>;
(5)2mol X和1mol Y在容器M中反应并达到平衡,x的平衡转化率为50%,则平衡时,c(X)=$\frac{(1-50%)×2mol}{1L}$=1mol/L,C(Y)=$\frac{1mol-1mol×\frac{1}{2}}{1L}$=0.5mol/L,c(Z)=c(W)=$\frac{\frac{1}{2}×(2×50%)mol}{1L}$=0.5mol/L,k=$\frac{0.5×0.5}{0.5×1{\;}^{2}}$=0.5,所以其温度是350℃,
故答案为:350.
点评 本题考查的化学平衡的有关知识,明确化学平衡状态的判断方法、等效平衡、化学平衡的影响因素等知识点,注意恒容条件下,向体系中通入惰性气体是否影响平衡移动,为易错点.

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案| A. | CO2+H2O═H2CO3化合反应 | |
| B. | Cu2(OH)2CO3═2CuO+H2O+CO2↑ 分解反应 | |
| C. | CuO+CO═Cu+CO2 置换反应 | |
| D. | NaCl+AgNO3═AgCl↓+NaNO3复分解反应 |
| A. | 向烧碱液中通入过量的二氧化碳:2OH-+CO2═CO32-+H2O | |
| B. | 向纯碱溶液通入足量的二氧化碳:CO32-+CO2+H2O═2HCO3- | |
| C. | 向硅酸钠水液中通人少量的二氧化碳:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| D. | 向次氯酸钠溶液中通人少量的二氧化碳:ClO-+CO2+H2O═HClO+HCO3- |
| A. | 0.3 mol/L | B. | 0.03 mol/L | C. | 0.05 mol/L | D. | 0.04 mol/L |
 某一化学兴趣小组的同学在家中进行实验,按照图示连接好线路,发现图B中的灯泡亮了.由此得出的以下结论中正确的是( )
某一化学兴趣小组的同学在家中进行实验,按照图示连接好线路,发现图B中的灯泡亮了.由此得出的以下结论中正确的是( )| A. | NaCl是非电解质 | |
| B. | NaCl溶液是电解质 | |
| C. | NaCl在水溶液中电离出了可以自由移动的离子 | |
| D. | 在NaCl溶液中,水电离出了大量的离子 |
 ⑤聚乙烯 ⑥
⑤聚乙烯 ⑥
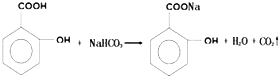

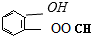 、
、 、
、
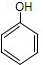 ,聚乙二酸乙二酯H0
,聚乙二酸乙二酯H0 OCOCOOCH2CH2
OCOCOOCH2CH2 OH.
OH. 合成氨工业、硝酸工业、硫酸工业是化学工业的重要组成部分.请回答下列问题:
合成氨工业、硝酸工业、硫酸工业是化学工业的重要组成部分.请回答下列问题: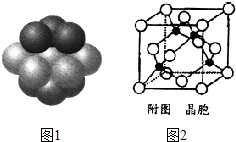 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题: