题目内容
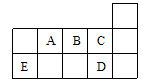
(10分)有A、B、C、D、E、F六种短周期元素,原子序数依次增大,且分属于四个主族。已知A的一种核素的原子核只有质子,B原子的最外层电子数是次外层电子数的2倍。B原子的最外层电子数是D、E原子最外层电子数之和,C原子的最外层电子数是D、F原子最外层电子数之和。请回答下列问题:
(1) 写出由A、B两种元素组成的具有10个电子的分子的电子式
(2) 用电子式表示A与D形成化合物的过程 ;
(3) A、B、C、D、E、F原子半径由大到小的顺序为 ,
(4) B、C、F氢化物稳定性由强到弱的顺序为 (用化学式表示),
(5) 写出一个化学方程式证明B和C的非金属性强弱 。
(1) 写出由A、B两种元素组成的具有10个电子的分子的电子式
(2) 用电子式表示A与D形成化合物的过程 ;
(3) A、B、C、D、E、F原子半径由大到小的顺序为 ,
(4) B、C、F氢化物稳定性由强到弱的顺序为 (用化学式表示),
(5) 写出一个化学方程式证明B和C的非金属性强弱 。
(1)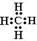 ;(2)
;(2)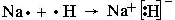 ;
;
(3)Na>Al>Si>C>N>H;(4)NH3>CH4>SiH4;(5)HNO3+NaHCO3="Na" NO3+H2O+CO2↑
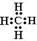 ;(2)
;(2)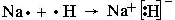 ;
;(3)Na>Al>Si>C>N>H;(4)NH3>CH4>SiH4;(5)HNO3+NaHCO3="Na" NO3+H2O+CO2↑
考查原子核外电子的排布规律及元素周期律的应用。A的一种核素的原子核只有质子,说明A是氢元素,属于第IA。B原子的最外层电子数是次外层电子数的2倍,说明B是碳元素,属于第ⅣA。B原子的最外层电子数是D、E原子最外层电子数之和,则D和E应该是第IA和第ⅢA。又因为D的原子序数大于B的小于E的,所以是钠,E是铝。因为C的原子序数大于碳的,小于钠的,因此C的最外层电子数只能是5、6或7。又因为C原子的最外层电子数是D、F原子最外层电子数之和,则F的最外层电子数至少是4个,而F的原子序数大于铝的,所以F可能是硅、磷、硫。因为六种因素只能是分属于四个主族,所以F只能是硅,C只能是氮。
(1)碳和氢形成的10电子微粒是甲烷,由极性键形成的共价化合物。
(2)钠属于活泼的金属,和氢可形成离子化合物氢化钠。
(3)同主族自上而下原子半径逐渐增大,同周期自左向右原子半径逐渐减小,所以原子半径大小顺序为Na>Al>Si>C>N>H。
(4)非金属性越强,氢化物越稳定,所以强弱顺序为NH3>CH4>SiH4。
(5)可以利用较强的酸制取较弱的离子验证非金属性强弱,即方程式为HNO3+NaHCO3="Na" NO3+H2O+CO2↑。
(1)碳和氢形成的10电子微粒是甲烷,由极性键形成的共价化合物。
(2)钠属于活泼的金属,和氢可形成离子化合物氢化钠。
(3)同主族自上而下原子半径逐渐增大,同周期自左向右原子半径逐渐减小,所以原子半径大小顺序为Na>Al>Si>C>N>H。
(4)非金属性越强,氢化物越稳定,所以强弱顺序为NH3>CH4>SiH4。
(5)可以利用较强的酸制取较弱的离子验证非金属性强弱,即方程式为HNO3+NaHCO3="Na" NO3+H2O+CO2↑。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 ;B、C可形成离子化合物B3C2,
;B、C可形成离子化合物B3C2,