题目内容
某学生利用高锰酸钾分解制氧气的反应,测定室温下的气体摩尔体积,实验装置如下。
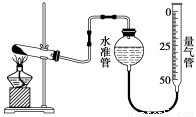
部分实验步骤:①装好实验装置。② _。
③把适量的高锰酸钾粉末放入干燥的试管中,准确称量试管和高锰酸钾粉末的质量为
a g。④加热,开始反应,直到产生一定量的气体。⑤停止加热。⑥测量收集到的气体的体积。⑦准确称量试管和残留物的质量为b g。⑧测量实验室的温度。回答下列问题。
(1)实验步骤的第②步是 _。
(2)以下是测量收集到的气体的体积时必须包括的几个步骤:①调整量气管高度,使其液面高度与水准管液面高度相平;②使装置内的气体都冷却至室温;③读取量气管中气体的体积。这三步操作的正确顺序是 (请填写步骤代号)。
(3)如果实验中得到的氧气体积是c L,水蒸气的影响忽略不计,则室温下气体摩尔体积的计算式为 (含a、b、c)。
(4)分析下列因素对实验结果的影响(假定其他操作均正确),并在横线上填“偏大”、“偏小”或“无影响”。
①高锰酸钾未完全分【解析】
_。
②实验前未将装置内的空气排出: _。
③未恢复至室温就读数: _。
(1)检查装置气密性 (2)②①③
(3) 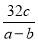 L·mol-1 (4)①无影响 ②无影响 ③偏大
L·mol-1 (4)①无影响 ②无影响 ③偏大
【解析】(3)设室温下的气体摩尔体积为Vm,由反应2KMnO4 K2MnO4+MnO2+O2↑可知,生成的O2的质量为(a-b) g,则
K2MnO4+MnO2+O2↑可知,生成的O2的质量为(a-b) g,则 =
= ,故Vm=
,故Vm= L·mol-1。
L·mol-1。
(4)①因为计算式中运用的是反应前后的质量差,因此高锰酸钾是否完全分解对实验结果无影响。③未恢复至室温,则气体体积偏大,即c偏大,故Vm偏大。

 考前必练系列答案
考前必练系列答案