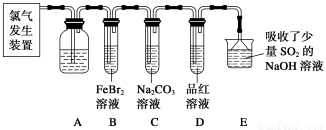
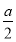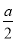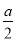题目内容
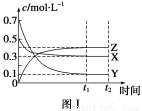
已知硫铁矿在沸腾炉中煅烧(4FeS2+11O2 8SO2+2Fe2O3),通入沸腾炉中的气体原料是过量的空气,其中N2的体积分数为0.80,O2的体积分数为0.20,则沸腾炉排出的气体中SO2的体积分数可能是( )
8SO2+2Fe2O3),通入沸腾炉中的气体原料是过量的空气,其中N2的体积分数为0.80,O2的体积分数为0.20,则沸腾炉排出的气体中SO2的体积分数可能是( )
A.0.18 B.0.12 C.0.16 D.0.20
B
【解析】4FeS2+11O2 2Fe2O3+8SO2,设空气为1体积,则N2为0.8体积,O2为0.2体积,0.2体积的O2最多生成SO2的体积为
2Fe2O3+8SO2,设空气为1体积,则N2为0.8体积,O2为0.2体积,0.2体积的O2最多生成SO2的体积为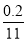 ×8=
×8=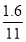 ,所以总体积为0.8+
,所以总体积为0.8+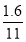 ,所以SO2的体积分数<
,所以SO2的体积分数< ×100%≈15.4%。B正确。
×100%≈15.4%。B正确。

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
含量/mg·L-1 | 9 360 | 83 | 200 | 1 100 | 16 000 | 1 200 | 118 |
(1)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过。
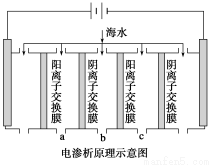
①阴极的电极反应式为__________________。
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式______________________________________。
③淡水的出口为a、b、c中的________出口。
(2)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如下图所示:
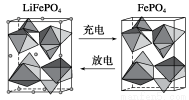
该电池电解质为传导Li+的固体材料。放电时该电极是电池的________极(填“正”或“负”),电极反应式为______________________。