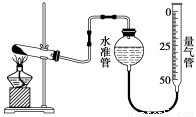
题目内容
下列相关反应的离子方程式书写正确的是( )
A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
B.硫酸铜溶液显酸性:Cu2++2H2O=Cu(OH)2↓+2H+
C.向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-=NH3↑+H2O
D.用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
D
【解析】A项,生成Fe2+和I2;B项,水解应用“ ”,且不能产生Cu(OH)2沉淀;C项,离子方程式应为HCO3-+NH4++Ca2++2OH-
”,且不能产生Cu(OH)2沉淀;C项,离子方程式应为HCO3-+NH4++Ca2++2OH- CaCO3↓+NH3↑+2H2O;D项正确。
CaCO3↓+NH3↑+2H2O;D项正确。

X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素。其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如下图。下列说法正确的是( )
| X |
| Y |
|
|
|
| W |
|
|
|
|
|
|
A.五种元素中,原子半径最大的是W
B.Y与Z形成的化合物都可以和盐酸反应
C.Y的简单阴离子比W的简单阴离子还原性强
D.Z与Q形成的化合物水溶液一定显酸性
已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
| 溶质的物质的量 浓度/mol·L-1 | 溶液的密度/g·cm-3 |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |

(1)表中硫酸的质量分数为________(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1 mol·L-1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为________ mol·L-1。
(3)将物质的量浓度分别为c2 mol·L-1和 c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________
c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________ 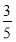 c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
c2 mol·L-1(设混合后溶液的体积变化忽略不计)。