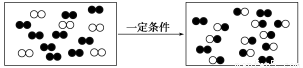
题目内容
常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-,已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是____________;所含阴离子相同的两种盐的化学式是__________________。
(2)D的化学式为__________________,D溶液显碱性的原因是_________________(用离子方程式表示)。
(3)A和C的溶液反应的离子方程式是______________________________________;
E和氨水反应的离子方程式是____________________________________________。
(4)若要检验B中所含的阳离子,正确的实验方法是______________________________。
(1)Cu2+、Fe3+ (NH4)2SO4、Al2(SO4)3
(2)Na2CO3 CO32-+H2O HCO3-+OH-
HCO3-+OH-
(3)Ag++Cl-=AgCl↓ Al3++3NH3·H2O=Al(OH)3↓+3NH4+
(4)取少量B于试管中,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸放在试管口,观察是否变蓝色
【解析】由于盐溶液没有颜色,所以没有Cu2+和Fe3+;根据实验现象可知,A、B、C、D、E分别为BaCl2、(NH4)2SO4、AgNO3、Na2CO3、Al2(SO4)3;检验NH4+,常用的方法是将铵盐与浓NaOH溶液共热,看是否能够产生使湿润的红色石蕊试纸变蓝的气体。

 口算能手系列答案
口算能手系列答案为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验,可选用试剂:KSCN溶液、K3[Fe(CN)6]溶液、氯水。
(1)请完成下表:
操作 | 现象 | 结论 |
取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 |
| 存在Fe3+ |
取少量除尽Ag+后的溶液于试管中,加入________,振荡 |
| 存在Fe2+ |
【实验结论】 Fe的氧化产物为Fe2+和Fe3+。
Ⅱ.AgNO3的热稳定性
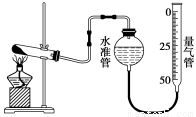
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束后,试管中残留固体为黑色。
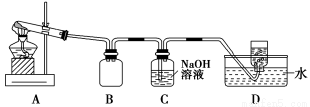
(2)装置B的作用是________。
(3)经小组讨论并验证该无色气体为O2,其验证方法是________。
(4)【查阅资料】 Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水。
【提出设想】 试管中残留的黑色固体可能是:ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag和Ag2O。
【实验验证】 该小组为验证上述设想,分别取少量黑色固体放入试管中,进行了如下实验。
实验编号 | 操作 | 现象 |
a | 加入足量氨水,振荡 | 黑色固体不溶解 |
b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验评价】 根据上述实验,不能确定固体产物成分的实验是________(填实验编号)。
【实验结论】 根据上述实验结果,该小组得出AgNO3固体热分解的产物有________。
海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
含量/mg·L-1 | 9 360 | 83 | 200 | 1 100 | 16 000 | 1 200 | 118 |
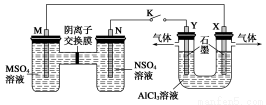
(1)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过。
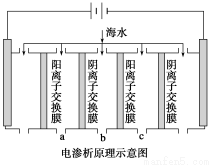
①阴极的电极反应式为__________________。
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式______________________________________。
③淡水的出口为a、b、c中的________出口。
(2)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如下图所示:
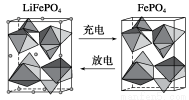
该电池电解质为传导Li+的固体材料。放电时该电极是电池的________极(填“正”或“负”),电极反应式为______________________。