题目内容
3.根据下列实验事实判断所测液体样品最有可能是纯水的是( )| A. | 室温下测定其pH等于7 | |
| B. | 一个标准大气压下测定其沸点为100℃ | |
| C. | 电解时产生H2、O2的体积比为2:1 | |
| D. | 室温时为无色的液体 |
分析 A、不水解的盐溶液在常温下是中性的,pH=7;
B、纯水在一个标准大气压的沸点是一个定值,纯净物才有固定的熔沸点;
C、电解含氧强酸或其钠盐、钾盐以及强碱等溶液的实质相当于电解水;
D、氯化钠、氯化钾、氢氧化钾、硫酸钠等大多数溶液常温下是无色的.
解答 解:A、室温下pH等于7的液体不一定是水,不水解的盐溶液如氯化钠等,在常温下是中性的,pH=7,故A错误;
B、纯净物才有固定的熔沸点,纯水在一个标准大气压的沸点是一个定值100℃,故B正确;
C、电解时产生H2、O2的体积比为2:1的溶液可以是硫酸钠、氢氧化钾、硫酸等,不一定是电解水,故C错误;
D、氯化钠、氯化钾、氢氧化钾、硫酸钠等大多数溶液常温下是无色的,室温时为无色的液体不一定是水,故D错误.
故选B.
点评 本题是一道物质的鉴别实验方案设计题,注意B是易错项,只有纯净物才有固定的熔沸点,难度中等.

练习册系列答案
相关题目
13.对于等物质的量浓度的Na2CO3和NaHCO3溶液,下列说法错误的是( )
| A. | 相同温度下两种溶液的pH:Na2CO3>NaHCO3 | |
| B. | 若分别升高温度,两种溶液的pH均减小 | |
| C. | 若分别加入少量NaOH,两溶液中c(CO32-)均增大 | |
| D. | 两溶液中的离子浓度均存在关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
14.下列实验事实与图象对应正确的是( )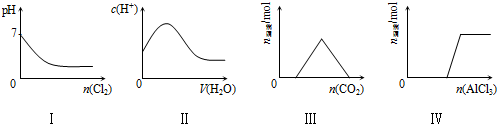

| A. | I表示向Na2SO3溶液中通入Cl2 | |
| B. | II表示向纯CH3COOH中逐滴加水并不断振荡 | |
| C. | III表示向KOH和Ca(OH)2混合液中通入CO2 | |
| D. | Ⅳ表示向NaOH溶液中逐滴加入AlCl3溶液并不断振荡 |
11.从碘的有机溶液中回收有机溶剂,可选用的实验装置是( )
| A. | 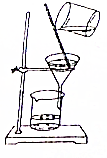 | B. | 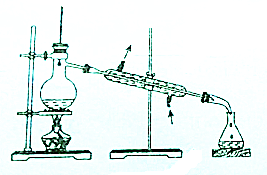 | ||
| C. | 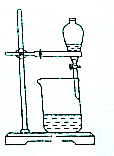 | D. | 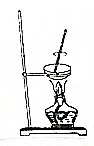 |
18.下列各组离子能大量共存的是( )
| A. | Fe3+、Mg2+、I-、SO42- | B. | NH4+、Al3+、NO3-、Cl- | ||
| C. | H+、Na+、Ca2+、ClO- | D. | Ba2+、K+、OH-、CO32- |
9.有德国重离子研究中心人工合成的第112号元素的正式名称为“Copernicium”,相应的元素符号位“Cn”.该元素的名称是为了纪念天文学家哥白尼而得名.该中心人工合成Cn的过程可表示为:7030Zn+20882Pb═277112Cn+10n.下列叙述中正确的是( )
| A. | 277112Cn的原子核内中子数比质子数多53 | |
| B. | Cn元素的相对原子质量为277 | |
| C. | 上述合成过程中属于化学变化 | |
| D. | Cn元素位于元素周期表的第六周期,是副族元素 |
7.区别SO2和CO2气体可选用的方法是( )
| A. | 通入品红溶液中 | B. | 用带火星的木条检验 | ||
| C. | 通入澄清石灰水中 | D. | 通入石蕊溶液中 |