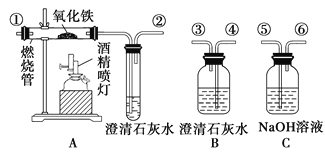
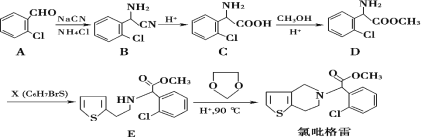
题目内容
【题目】![]() 、
、![]() 均是铬的重要化合物,回答下列问题:
均是铬的重要化合物,回答下列问题:
(1)基态Cr原子的未成对电子数为________________。
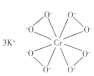
(2)![]() 的结构如图所示。
的结构如图所示。
①下列有关![]() 的说法正确的是__________(填标号)。
的说法正确的是__________(填标号)。
A.含离子键、σ键 B.含离子键、σ键和π键
C.氧原子与中心原子间形成配位键 D.铬显+10价
②已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量,![]() 。氧的第一电子亲和能E1为__________kJ/mol;△H2>0,其原因是_____________________________________。
。氧的第一电子亲和能E1为__________kJ/mol;△H2>0,其原因是_____________________________________。
(3)雷氏盐的化学式为![]() 。
。
①H、C、N、O四种元素的电负性由大到小的顺序为__________________。
②其阳离子的中心原子的杂化方式为_________________,配体之一NH3分子的立体构型为______。
③与配体NCSˉ互为等电子体的阴离子有![]() 等,分子有_____________________(写1种);画出
等,分子有_____________________(写1种);画出![]() 的结构式:_____________________________。
的结构式:_____________________________。
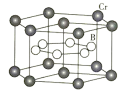
(4)![]() 的晶体密度为
的晶体密度为![]() ,晶体结构(如下图)为六棱柱,底边边长为
,晶体结构(如下图)为六棱柱,底边边长为![]() ,高为
,高为![]() ,设阿伏加德罗常数的值为NA,则a2c=_______________(列出计算式)。
,设阿伏加德罗常数的值为NA,则a2c=_______________(列出计算式)。
【答案】6 AC 140 Oˉ带负电荷,对再得到的电子产生排斥,克服斥力需消耗能量 O>N>C>H ![]() 三角锥形 CO2(或CS2、N2O等)
三角锥形 CO2(或CS2、N2O等) ![]()
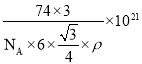
【解析】
(1)根据基态Cr原子核外电子排布分析;
(3)①非金属性越强,电负性越大;
②根据价层电子对互斥理论判断;
③根据同族替换和等量代换原则找等电子体;
(4)根据均摊法确定晶胞所含微粒个数,从而确定晶胞质量,根据![]() 计算晶胞体积,根据几何知识根据晶胞体积计算a2c。
计算晶胞体积,根据几何知识根据晶胞体积计算a2c。
(1)Cr是24号元素,其原子核外有24个电子,根据能量最低原理可写出电子排布式为1s22s22p63s23p63d54s1,Cr原子有6个未成对电子;
(2)①钾离子和CrO![]() 之间形成离子键,O原子之间为σ键,不含π键;根据共价键的饱和性,O原子可以形成2个共价键,图示结构氧原子形成3个单键,说明有一个配位键,O原子提供孤电子对,Cr3+提供空轨道;据图可知该物质中O原子之间形成过氧键,所以O元素化合价为-1价,根据电中性原则可知Cr为+5价,综上所述选AC;
之间形成离子键,O原子之间为σ键,不含π键;根据共价键的饱和性,O原子可以形成2个共价键,图示结构氧原子形成3个单键,说明有一个配位键,O原子提供孤电子对,Cr3+提供空轨道;据图可知该物质中O原子之间形成过氧键,所以O元素化合价为-1价,根据电中性原则可知Cr为+5价,综上所述选AC;
②根据![]() 可知氧的第一电子亲和能E1为140 kJ/mol;
可知氧的第一电子亲和能E1为140 kJ/mol;
Oˉ带负电荷,对再得到的电子产生排斥,克服斥力需消耗能量,所以△H2>0;
(3)①非金属性O>N>C>H,所以电负性O>N>C>H;
②其阳离子为NH![]() ,中心原子的价层电子对数为
,中心原子的价层电子对数为![]() =4,为sp3杂化;NH3分子的中心原子价层电子对数为4,含一对孤电子对,所以立体构型为三角锥形;
=4,为sp3杂化;NH3分子的中心原子价层电子对数为4,含一对孤电子对,所以立体构型为三角锥形;
③NCSˉ价电子数为16,原子数为3,用S、O代替Nˉ可得互为等电子的分子有CO2、CS2,同理还有N2O;F电负性较强,容易形成氢键,根据共价键的饱和性可知![]() 中有氢键,所以其结构式为
中有氢键,所以其结构式为![]() ;
;
(4)根据均摊法,晶胞中Cr的数目为![]() =3,B的数目为6,所以晶胞的质量为m=
=3,B的数目为6,所以晶胞的质量为m=![]() ,根据几何知识,晶胞的体积为V=
,根据几何知识,晶胞的体积为V=![]() nm3,晶胞的密度
nm3,晶胞的密度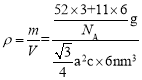 ,解得a2c=
,解得a2c=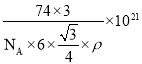 cm3
cm3

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案