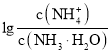题目内容
【题目】人类过多地使用化石燃料,造成了二氧化碳的大量排放,致使地球气温上升。二氧化碳是温室气体,也是一种重要的资源,如以CO2为基本原料可合成甲醇。回答下列问题:
(1)已知下列热化学方程式:
ⅰ.![]()
![]()
ⅱ.![]()
![]()
则ⅲ.![]()
![]() ________
________![]()
(2)Deluzarche等人在吸附有氢气的![]() 催化剂上通入CO2发生反应,该过程的反应机理如下:
催化剂上通入CO2发生反应,该过程的反应机理如下:

其中涉及非极性键变化的过程是______(填上图中的数字序号),写出上述过程中总反应的化学方程式:_____。
(3)一定条件下,向某密闭容器中按照![]() 投料,发生反应ⅲ,反应达到平衡时,容器中甲醇的体积分数与压强、温度的关系如下图所示:
投料,发生反应ⅲ,反应达到平衡时,容器中甲醇的体积分数与压强、温度的关系如下图所示:

由上图可知,反应物的转化率与压强的关系是:压强增大,CO2的转化率________(填“减小”“不变”或“增大”),温度为265℃时的平衡常数Kp=________![]() (Kp为用分压表示的平衡常数,分压=总压×体积分数)(保留小数点后四位)。
(Kp为用分压表示的平衡常数,分压=总压×体积分数)(保留小数点后四位)。
(4)将一定量的![]() 、
、![]() 混合气体通入某密闭容器中,在催化剂作用下生成
混合气体通入某密闭容器中,在催化剂作用下生成![]() ,不同压强下,平衡时混合气体中
,不同压强下,平衡时混合气体中![]() 的体积分数随温度的变化如图所示。
的体积分数随温度的变化如图所示。

则A、B、C三点的平衡常数由大到小的顺序为____(用![]() 、
、![]() 、
、![]() 表示),E点变为D点的措施是____。
表示),E点变为D点的措施是____。
(5)以特殊的纳米材料为电极,一定浓度的硫酸作为电解质溶液,![]() 为原料通过电化学方法可制得甲醇,则生成甲醇的电极反应式为_____。
为原料通过电化学方法可制得甲醇,则生成甲醇的电极反应式为_____。
【答案】-49.6 ① 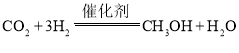 增大 0.0036
增大 0.0036 ![]() 减小压强
减小压强 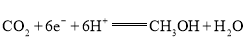
【解析】
(1)根据盖斯定律计算反应ⅲ的焓变;
(2)根据流程图,氢气、CO2在![]() 催化剂表面上反应生成CH3OH;
催化剂表面上反应生成CH3OH;
(3)根据b点,温度为265℃、压强为8MPa,甲醇的百分含量为10%,利用“三段式”计算平衡常数;
(4)升高温度,甲醇的体积分数减小,说明升高温度平衡逆向移动;平衡常数只与温度有关;
(5) ![]() 生成甲醇,碳元素化合价由+4降低为-2,CO2得电子发生还原反应生成甲醇;
生成甲醇,碳元素化合价由+4降低为-2,CO2得电子发生还原反应生成甲醇;
(1)ⅰ.![]()
![]()
ⅱ.![]()
![]()
根据盖斯定律ⅰ×![]() +ⅱ×
+ⅱ×![]() 得
得![]()
![]()
![]() -49.6
-49.6![]() ;
;
(2)根据流程图,①是H-H键断裂,涉及非极性键变化的是过程①;氢气、CO2在![]() 催化剂表面上反应生成CH3OH,总反应的化学方程式是
催化剂表面上反应生成CH3OH,总反应的化学方程式是 ;
;
(3)根据图示,压强增大,CO2的转化率增大;
根据b点,温度为265℃、压强为8MPa,甲醇的百分含量为10%;
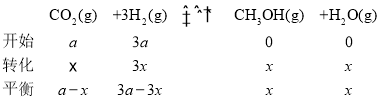
![]() ,x=
,x=![]() ;则平衡时CO2的压强为
;则平衡时CO2的压强为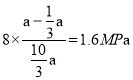 、则平衡时H2的压强为
、则平衡时H2的压强为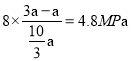
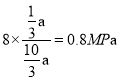 、则平衡时H2O的压强为
、则平衡时H2O的压强为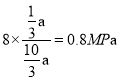 ,温度为265℃时的平衡常数Kp=
,温度为265℃时的平衡常数Kp=![]() 0.0036
0.0036![]() ;
;
(4)升高温度,甲醇的体积分数减小,说明升高温度平衡逆向移动,所以升高温度K减小,所以![]() >
>![]() ; 平衡常数只与温度有关,所以
; 平衡常数只与温度有关,所以![]() =
=![]() ,故
,故![]() ;减小压强,平衡逆向移动,甲醇体积分数减小,所以E点变为D点的措施是减小压强;
;减小压强,平衡逆向移动,甲醇体积分数减小,所以E点变为D点的措施是减小压强;
(5) ![]() 生成甲醇,碳元素化合价由+4降低为-2, 1molCO2得6mol电子生成1mol甲醇,生成甲醇的电极反应式是
生成甲醇,碳元素化合价由+4降低为-2, 1molCO2得6mol电子生成1mol甲醇,生成甲醇的电极反应式是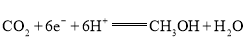 。
。

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案【题目】已知:2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1。某温度下的平衡常数为400。此温度下,在1 L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表。下列说法中不正确的是( )
CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1。某温度下的平衡常数为400。此温度下,在1 L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表。下列说法中不正确的是( )
物质 | CH3OH | CH3OCH3 | H2O |
c/mol·L-1 | 0.08 | 1.6 | 1.6 |
A. 此时刻反应达到平衡状态
B. 容器内压强不变时,说明反应达平衡状态
C. 平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率不变
D. 平衡时,反应混合物的总能量降低40 kJ
【题目】下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如表所示:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
下列说法正确的是
A.ΔH1<0,ΔH2>0
B.反应①②③的反应热满足关系:ΔH1-ΔH2=ΔH3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取降温措施