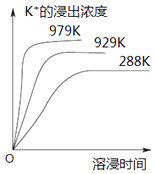
��Ŀ����
����Ŀ������������Ҫ�ɷ���Al2O3����SiO2��Fe2O3��MgO�����ʣ�����ȡ�����������ֹ����������£�
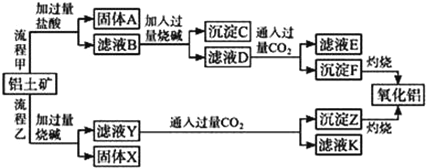
��ش��������⣺
��1������A����Ҫ�ɷ���______________��д���ƣ���
��2��������������ռӦ�����ӷ���ʽΪ______��______��
��3������������������Ƶ����ֵ��ʣ�д���÷�Ӧ��ѧ����ʽ______________��
��4��ָ�������ҵ�һ��ȱ����____________��
��5���������뽹̿�Ļ�����ڵ����и��¼��ȷ�Ӧ���Ƶ����ͷǽ�������AlN��һ����ѧ��������X����֪ÿת��6.02��1023�����ӣ���0.5mol������X���ɣ��˷�Ӧ�Ļ�ѧ����ʽ________________��
���𰸡� �������� Al2O3+2OH_=2AlO2_+ H2O SiO2+2OH_ =SiO32��+H2O 2Al2O3==4Al+ 3O2�� �������к��ж����������� Al2O3+N2+3C![]() 2AlN+3CO��
2AlN+3CO��
�����������̼ף��������м��������ϡ���ᣬSiO2�������Ӧ��Al2O3��Fe2O3��MgO���������ᷴӦ������Ӧ���Ȼ����Ӧ����ʽΪAl2O3��6H��===2Al3����3H2O��Fe2O3��6H��===2Fe3����3H2O��MgO��2H��===Mg2����H2O����ӦҺ�м�������ռ���Al3����ΪAlO2����Mg2����Fe3����ΪMg��OH��2��Fe��OH��3���������˺�����Һ��ͨ�������Ķ�����̼������������Al��OH��3��������Ӧ����ʽΪAlO2����CO2��2H2O��Al��OH��3����HCO3�������������������м������������������Һ��Fe2O3��MgO���������Ʋ���Ӧ��SiO2��Al2O3����ǿ�Ӧ���ɹ����ƺ�ƫ����������������Һ��ͨ�������Ķ�����̼����Ӧ������Al��OH��3����������
��1����������������A����Ҫ�ɷ��Ƕ������裻��ȷ�𰸣� �������衣
��2����������Al2O3��SiO2����ǿ�Ӧ������ƫ�����κ����Σ���Ӧ�����ӷ���ʽ�ֱ�Ϊ��Al2O3+2OH-=2 AlO2��+ H2O �� SiO2+2OH_ =SiO32��+H2O����ȷ�𰸣�Al2O3+2OH_=2AlO2��+ H2O �� SiO2+2OH_ =SiO32��+H2O��
��3������������������Ƶý���������������Ӧ��ѧ����ʽ2Al2O3==4Al+ 3O2������ȷ�𰸣�2Al2O3==4Al+ 3O2����
��4��SiO2��Al2O3����ǿ�Ӧ���ɹ����ƺ�ƫ�����ƣ����ˣ���Һ��ͨ�������Ķ�����̼����Ӧ������Al��OH��3�������ᣬ���Ⱥõ��������Ͷ������裬���������к��ж����������� ����ȷ�����������к��ж����������ʡ�
��5���������뽹̿�Ļ�����ڵ����и��¼��ȷ�Ӧ���Ƶ����ͷǽ�������AlN��һ����ѧ��������X������Ԫ���غ����֪��X��Ӧ������Ԫ�غ�̼Ԫ������֪ÿת��6.02��1023�����Ӽ�1mol��������0.5mol������X�������ɵ���ת���غ����ɵ���X��C�Ļ��ϼ�Ϊ![]() ,����X��CO�����Ը÷�Ӧ�Ļ�ѧ����ʽΪAl2O3+N2+3C
,����X��CO�����Ը÷�Ӧ�Ļ�ѧ����ʽΪAl2O3+N2+3C![]() 2AlN+3CO����ȷ�𰸣�Al2O3+N2+3C
2AlN+3CO����ȷ�𰸣�Al2O3+N2+3C![]() 2AlN+3CO��
2AlN+3CO��

����Ŀ���±���������֮��ͨ��һ����Ӧ������ʵ������ͼ��ʾת����ϵ����

ѡ�� | X | Y | Z | ��ͷ���������ֵķ�Ӧ���� |
A | SiO2 | Na2SiO3 | H2SiO3 | ����Na2CO3���� |
B | NaCl | NaHCO3 | Na2CO3 | �ڼ��� |
C | N2 | NO2 | HNO3 | �ۼ��� |
D | C | CO | CO2 | ������̿�� |
A. A B. B C. C D. D
����Ŀ���о�PM 2.5��SO2��NOx�ȣ��Լ���������������Ҫ���壮ȡij����������ˮ�����Ƴɴ���Һ�������������ӵĻ�ѧ��ּ���Ũ�����±���
���� | K+ | Na+ | NH4+ | H+ | SO42�� | NO3�� | Cl�� |
Ũ��/molL��1 | 4��10��6 | 6��10��6 | 2��10��5 | a | 2��10��5 | 3��10��5 | 2��10��5 |
��ش��������⣺
��1�����ݱ������ݼ���˴���Һ��c��H+��Ũ��aΪ________mol/L��
��2��NOx������β���е���Ҫ��Ⱦ��֮һ��
����������������ʱ�ĸ��»�����N2��O2��Ӧ����Ӧ�Ļ�ѧ����ʽ��__________��
��NOx���γ����꣬��NO2�γ��������Ҫ��Ӧ��______________��д��ѧ����ʽ����
��3��Ϊ����SO2���ŷţ�����ȡ�Ĵ�ʩ�У�
����ȼú�м�����ʯ�ҿ�����������ã�SO2�����պ�ת����һ����Ԫ�ص����̬�Ļ�����û����ﳣ��Ϊ����������ԭ�ϣ����ڶ��������е�������___________��
�����������е�SO2���������ʿ������ռ�����_______������ţ���
a��NaOH b��H2SO4 c��NaHSO3 d. Na2SO3
���Ṥҵ�е�β��SO2����ѭ�����ã�д��SO2ת��ΪSO3��Ӧ�Ļ�ѧ����ʽ_______��
����Ŀ����ش��������⣮
��1��ˮ�ĵ���ƽ��������ͼ��ʾ����A���ʾ25��ʱˮ�ĵ����ƽ��ʱ������Ũ�ȣ�B���ʾ100��ʱˮ�ĵ����ƽ��ʱ������Ũ�ȣ� 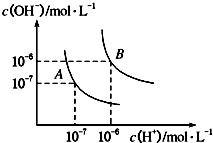
��100��ʱ1molL��1��NaOH��Һ�У���ˮ�������c��H+��=molL��1 �� KW��25�棩KW��100�棩�����������������=������
��25��ʱ����ˮ�ĵ���ƽ����ϵ�м�������NH4Cl���壬��ˮ�ĵ���ƽ���Ӱ��������ٽ����������ơ���Ӱ�족����
��2������ƽ�ⳣ���Ǻ���������ʵ���̶�ǿ����������֪������ݣ�
��ѧʽ | ����ƽ�ⳣ����25�棩 |
HCN | K=4.9��10��10 |
CH3COOH | K=1.8��10��5 |
H2CO3 | K1=4.3��10��7��K2=5.6��10��11 |
��25��ʱ���е�Ũ�ȵ�a��NaCN��Һ b��CH3COONa ��Һ c��Na2CO3��Һ��������Һ��pH�ɴ�С��˳��Ϊ��������ţ�
��25��ʱ����Ũ�ȵ�CH3COOH��Һ��NaOH��Һ�������ϣ���c��Na+��c��CH3COO���������������������=������