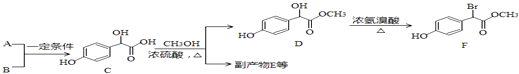
题目内容
【题目】在生产生活中,我们会遇到各种各样的化学反应。请按要求回答下列问题:
(1)焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4Cl、N2、Fe2O3、Fe、FeCl3 和 X。
①根据题意,可判断出X是_____________(写化学式)
②写出并配平该反应的化学方程式,并用双线桥标出电子转移的方向和数目:______。
(2)铝元素是自然界中含量最多的的金属元素,应用广泛。金属铝既能与酸反应又能与强碱反应,请写出铝与强碱反应的离子方程式__________________________________________ 。
(3)Na2O2可用作呼吸面具的供氧剂, 发生反应的化学方程式为__________________________。
(4)“水玻璃”长期暴露在空气中会变质,这是因为“水玻璃”与空气中少量二氧化碳接触,生成了乳白色的凝胶状沉淀的缘故。写出反应的离子方程式_________________________________。
(5)小苏打可作胃药,请写出其中和胃酸时的离子方程式______________________ 。
(6)在反应 3BrF3+5H2O = HBrO3+Br2+9HF+O2 中,被氧化的元素是____________,当有5 mol水反应时,由H2O还原的BrF3为______________mol。
【答案】 H2O 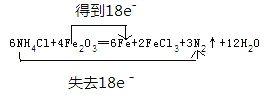 2Al+2OH-+2H2O=2AlO2-+3H2↑ 2Na2O2+2CO2=2Na2CO3+O2 2Na2O2+2H2O=4NaOH+O2↑ SiO32-+CO2+H2O=H2SiO3↓+CO32- HCO3-+H+=H2O+CO2↑ O、Br 4/3
2Al+2OH-+2H2O=2AlO2-+3H2↑ 2Na2O2+2CO2=2Na2CO3+O2 2Na2O2+2H2O=4NaOH+O2↑ SiO32-+CO2+H2O=H2SiO3↓+CO32- HCO3-+H+=H2O+CO2↑ O、Br 4/3
【解析】(1)①根据焊药为氯化铵,其作用是消除焊接处的铁锈可知反应物为NH4Cl、Fe2O3,则该反应的生成物为FeCl3、N2、Fe和X,根据原子守恒可知X中含有H、O元素,则X为H2O;②由反应物和生成物可知,NH4Cl+Fe2O3→Fe+FeCl3+N2↑+H2O,该反应Fe元素的化合价由+3价降低为0,N元素的化合价由-3价升高到0,根据电子守恒可知,得电子数=失去电子数=18e-,则6NH4Cl+Fe2O3→6Fe+FeCl3+3N2↑+H2O,再质量守恒定律可知,配平的化学反应为6NH4Cl+4Fe2O3=6Fe+2FeCl3+3N2↑+12H2O,电子转移情况为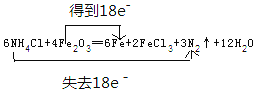 。(2)铝与强碱反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。(3)Na2O2能与水或二氧化碳反应产生氧气,可用作呼吸面具的供氧剂,发生反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑。(4)“水玻璃”是硅酸钠的水溶液,与空气中少量二氧化碳接触,生成了乳白色的凝胶状沉淀是硅酸,反应的离子方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-。(5)小苏打是碳酸氢钠,可作胃药,中和胃酸时的离子方程式为HCO3-+H+=H2O+CO2↑。(6)在氧化还原反应3BrF3+5H2O=HBrO3+Br2+9HF+O2中,化合价升高的元素是水中的氧元素和BrF3中的溴元素,氧、溴元素被氧化,当有5mol水反应时,化合价升高的元素之一是水中的氧元素从-2价升到0价,被氧化的水的物质的量为2mol,化合价降低的元素是BrF3中的溴元素从+3价降到0价,被还原的物质的量为2mol,其中由H2O还原的BrF3为:2×2/3=4/3mo。
。(2)铝与强碱反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。(3)Na2O2能与水或二氧化碳反应产生氧气,可用作呼吸面具的供氧剂,发生反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑。(4)“水玻璃”是硅酸钠的水溶液,与空气中少量二氧化碳接触,生成了乳白色的凝胶状沉淀是硅酸,反应的离子方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-。(5)小苏打是碳酸氢钠,可作胃药,中和胃酸时的离子方程式为HCO3-+H+=H2O+CO2↑。(6)在氧化还原反应3BrF3+5H2O=HBrO3+Br2+9HF+O2中,化合价升高的元素是水中的氧元素和BrF3中的溴元素,氧、溴元素被氧化,当有5mol水反应时,化合价升高的元素之一是水中的氧元素从-2价升到0价,被氧化的水的物质的量为2mol,化合价降低的元素是BrF3中的溴元素从+3价降到0价,被还原的物质的量为2mol,其中由H2O还原的BrF3为:2×2/3=4/3mo。

 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案