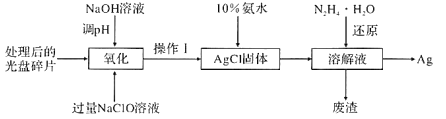
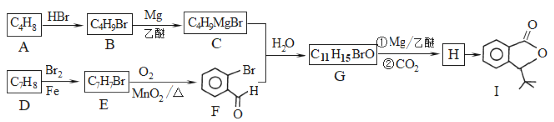
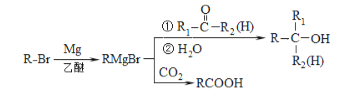
题目内容
【题目】I.某温度下,在2L密闭容器中X、Y、Z三种物质(均为气态)间进行反应,其物质的量随时间的变化曲线如图。依图回答:

(1)该反应的化学方程式可表示为____________。
(2)反应起始至t min(设t=5),Y的平均反应速率是________。
(3)在t min时,该反应达到了平衡状态,下列可判断反应已达到该状态的是________(选填字母)。
a.X、Y、Z的反应速率相等
b.X、Y的反应速率比为2:3
c.混合气体的密度不变
d.生成1mol Z的同时生成2mol X
e.X、Y、Z物质的量之比等于化学计量数比
f.混合气体的总压强不再发生改变
II.燃料电池是利用燃料(如CO、H2、CH4等)与氧气反应,将反应产生的化学能转变为电能的装置,通常用氢氧化钾作为电解质溶液。完成下列关于甲烷(CH4)燃料电池的填空:
(1)已知燃料电池的总反应式为CH4+2O2+2KOH==K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-== CO32-+7H2O,这个电极是燃料电池的______(填“正极”或“负极”),另一个电极上的电极反应式为:____________________。
(2)随着电池不断放电,电解质溶液的碱性__________(填“增强”、“减弱”或“不变”)。
(3)通常情况下,甲烷燃料电池的能量利用率_________(填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率。
【答案】2X![]() 3Y+Z 0.12mol/(Lmin) df 负极 2O2+4H2O+8e-==8OH- 减弱 大于
3Y+Z 0.12mol/(Lmin) df 负极 2O2+4H2O+8e-==8OH- 减弱 大于
【解析】
I.(1)化学反应中,各物质的物质的量的变化值与化学计量数呈正比,以此书写化学方程式;
(2)根据v=![]() 计算反应速率;
计算反应速率;
(3)当反应中各物质的物质的量不再变化时,反应达到平衡状态,各物质的浓度不变,由此衍生的一些物理量不变;
I.(1)由图象可以看出,X的物质的量逐渐减小,则X为反应物,Y、Z的物质的量逐渐增多,作为Y、Z为生成物,当反应到达2min时,△n(X)=0.8mol,△n(Y)=1.2mol,△n(Z)=0.4mol,化学反应中,各物质的物质的量的变化值与化学计量数呈正比,△n(X):△n(Y):△n(Z)=2:3:1,所以反应的化学方程式为:2X3Y+Z;
(2)v(Y)=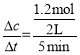 =0.12mol/(Lmin);
=0.12mol/(Lmin);
(3)a.同一反应不同物质的反应速率之比等于计量数之比,该反应中各物质反应速率不可能相等,故a错误;
b.化学反应速率之比等于化学计量数之比,无论是否达到平衡状态,X、Y的反应速率比都为2:3,故b错误;
c.由于反应在体积不变的密闭容器中进行,反应过程中气体的体积不变,质量不变,则混合气体的密度不变,不能判断是否达到平衡状态,故c错误;
d.生成1molZ的同时生成2molX,说明正逆反应速率相等,达到平衡状态,故d正确;
e.据图可知初始投料只有X,反应反应过程中X的物质的量减少,Y、Z的物质的量增多,所以三者物质的量之比在变,可能某一瞬间三者物质的量之比等于计量数之比,但不能说明反应达到平衡,故e错误;
f.容器体积一定,反应达到平衡状态时,各物质的物质的量不变,则混合气体的总压强不再发生改变,故f正确;
综上所述选df;
II.(1)甲烷失电子发生氧化反应,所以通入燃料的电极为负极,通入氧化剂的电极为正极,正极上电极反应式等于总反应减去负极反应为:2O2+4H2O+8e-=8OH-;
(2)电池工作一段时间后,因为消耗氢氧化钾所以碱性减弱,溶液的pH减小;
(3)甲烷燃烧时要放出热量、光能,所以燃料电池中甲烷的利用率比甲烷燃烧的能量利用率高。

【题目】为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。回答下列问题:
(1)Ag与Cu在同一族,则Ag在周期表中___(填“s”、“p”、“d”或“ds”)区。[Ag2(NH3)2]+中Ag+空的5s轨道和5p轨道以sp杂化成键,则该配离子的空间构型是___。
(2)下表是Fe和Cu的部分电离能数据:请解释I2(Cu)大于I2(Fe)的主要原因:______。
元素 | Fe | Cu |
第一电离能I1/kJ·mol-1 | 759 | 746 |
第二电离能I2/kJ·mol-1 | 1561 | 1958 |
(3)亚铁氰化钾是食盐中常用的抗结剂,其化学式为K4[Fe(CN)6]。
①CN-的电子式是______;1 mol该配离子中含σ键数目为____。
②该配合物中存在的作用力类型有_____(填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(4)MnO2的熔点(1660℃C)比MnS的熔点(1610℃)高,其主要原因是_________。
(5)第三代太阳能电池利用有机金属卤化物碘化铅甲胺(CH3NH3PbI3)半导体作为吸光材料,CH3NH3PbI3具有钙钛矿(AMX3)的立方结构,其晶胞如图所示。
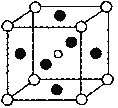
①AMX3晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则M处于____位置,X处于____位置。
③CH3NH3PbI3晶体的晶胞参数为anm,其晶体密度为dg·cm-3,则阿伏加德罗常数的值NA的计算表达式为______。
【题目】根据下表所示化学反应与数据关系:
化学反应 | 平衡常数 | 温度 | |
973 K | 1 173 K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
请回答:
(1)反应①是________(填“吸热”或“放热”)反应。
(2)写出反应③的平衡常数K3的表达式_______________________。
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有________(填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO浓度
(5)若反应③的逆反应速率与时间的关系如图所示:
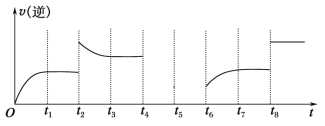
①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时________;t8时________。
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线__________。
【题目】锰是重要的合金材料和催化剂,在工农业生产和科技领域有广泛的用途。请回答下列问题:
(1)溶液中的Mn2+可被酸性![]() 溶液氧化为MnO4-,该方法可用于检验Mn2+。
溶液氧化为MnO4-,该方法可用于检验Mn2+。
①检验时的实验现象为_________。
②该反应的离子方程式为___________。
③ ![]() 可看成两分子硫酸偶合所得,若硫酸的结构式为
可看成两分子硫酸偶合所得,若硫酸的结构式为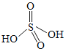 ,则
,则![]() 的结构式为_________。
的结构式为_________。
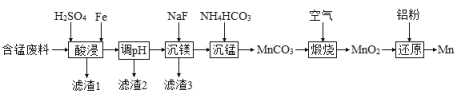
(2)实验室用含锰废料(主要成分![]() ,含有少量
,含有少量![]() )制备Mn的流程如下:
)制备Mn的流程如下:
已知:Ⅰ.难溶物的溶度积常数如下表所示:
难溶物 |
|
|
|
|
溶度积常数( | 4.0×10-38 | 1.0×10-33 | 1.8×10-11 | 1.8×10-13 |
Ⅱ.溶液中离子浓度≤10-5 mol·L-1时,认为该离子沉淀完全。
①“酸浸”时,![]() 将Fe氧化为Fe3+。该反应的离子方程式为________;该过程中时间和液固比对锰浸出率的影响分别如图1、图2所示:
将Fe氧化为Fe3+。该反应的离子方程式为________;该过程中时间和液固比对锰浸出率的影响分别如图1、图2所示:
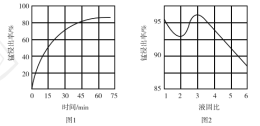
则适宜的浸出时间和液固比分别为___________、___________。
②若“酸浸”后所得滤液中c(Mn2+)=0.18 mol·L-1,则调pH”的范围为___________。
③“煅烧”反应中氧化剂和还原剂的物质的量之比为_______。“还原”时所发生的反应在化学上又叫做_________。