题目内容
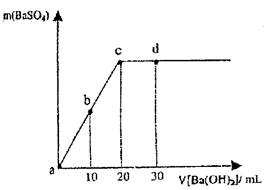
10mLNO、CO2的混合气体通过足量的Na2O2后,气体的体积变为5mL(相同状况),则CO2和NO的体积比不可能为 ( )
| A.1∶1 | B.2∶1 | C.3∶2 | D.1∶2 |
D
本题是CO2、NO的混合气体通过Na2O2时,体积变化的计算。
2CO2+2Na2O2==2Na2CO3+O2 ①
2NO+O2==2NO2 ②
①+②得: 2CO2+2NO+2Na2O2 ="=" 2Na2CO3+2NO2 ③
由此可得出下列推论:
(1)当V(CO2)=V(NO),反应恰好按③式进行,反应后
V总=1/2[V(CO2)+V(NO)]
(2)当V(CO2)>V(NO),反应按③式进行后,剩余CO2按①式进行,即体积仍减少一半,反应后 V总=1/2[V(CO2)+V(NO)]
(3)当V(CO2)<V(NO),反应按③式进行后,剩余NO体积不变化,反应后V总>1/2[V(CO2)+V(NO)] 。
根据上述讨论,现已知NO、CO2气体通过Na2O2后体积为原来的一半,故应满足(1)(2)两种推论结果,A、B、C均符合V(CO2)≥V(NO),只有D不符。
2CO2+2Na2O2==2Na2CO3+O2 ①
2NO+O2==2NO2 ②
①+②得: 2CO2+2NO+2Na2O2 ="=" 2Na2CO3+2NO2 ③
由此可得出下列推论:
(1)当V(CO2)=V(NO),反应恰好按③式进行,反应后
V总=1/2[V(CO2)+V(NO)]
(2)当V(CO2)>V(NO),反应按③式进行后,剩余CO2按①式进行,即体积仍减少一半,反应后 V总=1/2[V(CO2)+V(NO)]
(3)当V(CO2)<V(NO),反应按③式进行后,剩余NO体积不变化,反应后V总>1/2[V(CO2)+V(NO)] 。
根据上述讨论,现已知NO、CO2气体通过Na2O2后体积为原来的一半,故应满足(1)(2)两种推论结果,A、B、C均符合V(CO2)≥V(NO),只有D不符。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目