题目内容
常温下,向0.1 mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是
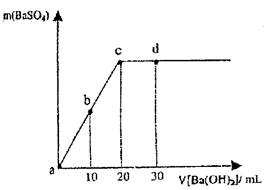

| A.c时刻硫酸溶液的体积为30 mL |
| B.b时刻溶液中SO42-的浓度约为0.5 mol·L-1 |
| C.d时刻溶液的OH-的浓度为0.04mol/L |
| D.溶液的导电能力:c<d="b<a" |
C
要分析图像的起点、拐点的含义。硫酸与氢氧化钡发生中和反应,C点恰好反应完全,因为二者浓度相同,所以体积相等,A项错误;b时刻SO42-沉淀一半,体积变为原来的1.5倍,SO42-的浓度约为0.1 /1.5=0.0667mol·L-1,B项错误;d时刻Ba(OH)2过量,c(OH-)=(0.1×10×2)/50=0.04mol/L,C项正确;b、d两点离子物质的量相等,但后者体积大,离子浓度小,导电性弱,导电能力c<d<b<a,D项错误,选C。

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目