��Ŀ����
��һ�ݻ�Ϊ2L���ܱ������У�����0.2mol��N2��0.6mol��H2����һ�������·������·�Ӧ��N2(g)+3H2(g) 2NH3(g)����H��0
2NH3(g)����H��0
��Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ����ش��������⣺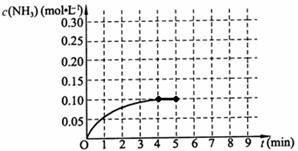
��1��������ͼ��д���÷�Ӧ�ﵽƽ��ʱH2��ת���� ��
��2����Ӧ�ﵽƽ���5����ĩ�����������������䣬���ı䷴Ӧ�¶ȣ���NH3�����ʵ���Ũ�Ȳ�����Ϊ ��������ţ���
a 0.20mol��L-1 b 0.12 mol��L-1
c 0.10 mol��L-1 d 0.08 mol��L-1
��3����Ӧ�ﵽƽ���5����ĩ�����������������䣬��ֻ�������������Сһ�룬ƽ���� �ƶ�������淴Ӧ������������Ӧ������������ѧƽ�ⳣ�� ������������١����䡱����
��4���ڵ�5����ĩ�������������Сһ������ڵ�8����ĩ�ﵽ�µ�ƽ�⣨��ʱNH3��Ũ��ԼΪ0.25 mol��L-1 ����������ͼ�л�����5����ĩ����ƽ��ʱNH3Ũ�ȵı仯���ߡ�
��1�� 50% ��2��a��c ��3��������Ӧ�����䣨4������ͼ��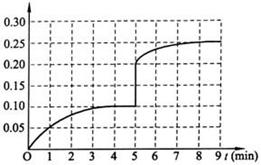
���������������1������ͼ���֪��ƽ��ʱ���������ʵ���Ũ����0.10mol/L����������������Ũ����0.15mol/L����������ת������0.15mol/L��0.3mol/L��100����50����
��2����������Ӧ�Ƿ��ȷ�Ӧ�����Ըı��¶�ƽ��һ�������ƶ��������ڷ�Ӧ���ת���ʲ�������100������������Ũ�Ȳ����ܳ���0.20mol/L������ѡac��
��3�����������������䣬��ֻ�������������Сһ�룬ѹǿ����ƽ��������Ӧ�����ƶ���������ƽ�ⳣ��ֻ���¶��й�ϵ������ƽ�ⳣ���Dz���ġ�
��4���ڵ�5����ĩ�������������Сһ���˲�䣬������Ũ�ȱ�Ϊ0.2mol/L����������ѹǿƽ��������Ӧ�����ƶ����������յ�ͼ��Ӧ����
���㣺������淴Ӧ���йؼ��㡢���������ƽ��״̬��Ӱ���
���������ж����������ƽ��״̬��Ӱ��ʱ��Ӧ��������������ԭ�������жϣ�ͬʱҪ���ݾ���Ļ�ѧ��Ӧ���塢��������


 2NH3��g��+Q��Q��0������Ӧ��NH3�����ʵ���Ũ�ȵı仯�����ͼ��
2NH3��g��+Q��Q��0������Ӧ��NH3�����ʵ���Ũ�ȵı仯�����ͼ��

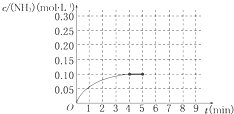 ��һ�ݻ�Ϊ2L���ܱ�������Ϊ���� 0.2mol��N2��0.6mol��H2����һ�������·������·�Ӧ��N2��g��+3H2��g��?2NH3��g����H��0��Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ��
��һ�ݻ�Ϊ2L���ܱ�������Ϊ���� 0.2mol��N2��0.6mol��H2����һ�������·������·�Ӧ��N2��g��+3H2��g��?2NH3��g����H��0��Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ��