题目内容
(2009?滨州模拟)在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:
N2(g)+3H2(g)
2NH3(g)△HPO反应中NH3的物质的量浓度的变化情况如图所示:请回答下列问题;
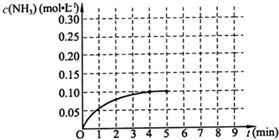
(1)根据如图,计算从反应开始到平衡时,平均反应速率v(NH3)为
(2)该反应的化学平衡常数表达式K
.
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
a 0.20mol?L-1 b 0.12mol?L-1 c 0.10mol?L-1 d 0.08mol?L-1
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡
(6)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol?L-1 ),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
N2(g)+3H2(g)
| ||

(1)根据如图,计算从反应开始到平衡时,平均反应速率v(NH3)为
0.025mol/(L?min)
0.025mol/(L?min)
.(2)该反应的化学平衡常数表达式K
| c2(NH3) |
| c(N2)×c3(H2) |
| c2(NH3) |
| c(N2)×c3(H2) |
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
ac
ac
.(填序号).a 0.20mol?L-1 b 0.12mol?L-1 c 0.10mol?L-1 d 0.08mol?L-1
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡
向正反应方向
向正反应方向
移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数不变
不变
(填“增大”、“减少”或“不变”).(6)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol?L-1 ),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
分析:(1)由图可知,4min达平衡,平衡时△c(NH3)=0.1mol/L,根据v=
计算v(NH3).
(2)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
(3)根据反应的可逆性特点以及温度改变平衡一定发生移动进行判断;
(4)体积缩小压强增大,增大压强平衡向体积减小的反应移动;平衡常数只受温度影响;
(5)先判断把容器的体积缩小一半的瞬间氨气的浓度,再结合平衡时的浓度作图.
| △c |
| △t |
(2)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
(3)根据反应的可逆性特点以及温度改变平衡一定发生移动进行判断;
(4)体积缩小压强增大,增大压强平衡向体积减小的反应移动;平衡常数只受温度影响;
(5)先判断把容器的体积缩小一半的瞬间氨气的浓度,再结合平衡时的浓度作图.
解答:解:(1)由图可知,4min达平衡,△c(NH3)=0.1mol/L,所以v(NH3)=
=0.025mol/(L?min),
故答案为:0.025mol/(L?min);
(2)N2(g)+3H2(g)
2NH3(g)的化学平衡常数k=
,
故答案为:
;
(3)该反应为可逆反应,反应物不可能完全转化,则NH3的物质的量浓度不可能为0.2mol/L,温度改变平衡一定发生移动,则NH3的物质的量浓度不可能为0.1mol/L,
故答案为:a、c;
(4)体积缩小压强增大,增大压强平衡向体积减小的反应移动,即向正反应移动;平衡常数只受温度影响,浓度不影响平衡常数,温度不变,平衡常数不变.
故答案为:向正反应方向;不变;
(5)把容器的体积缩小一半的瞬间氨气的浓度,氨气的浓度变为0.20mol/L,8min到达平衡后氨气浓度约为0.25mol/L,故第5分钟末到平衡时NH3浓度的变化曲线为 ,
,
故答案为: .
.
| 0.1mol/L |
| 4min |
故答案为:0.025mol/(L?min);
(2)N2(g)+3H2(g)
| ||
| c2(NH3) |
| c(N2)×c3(H2) |
故答案为:
| c2(NH3) |
| c(N2)×c3(H2) |
(3)该反应为可逆反应,反应物不可能完全转化,则NH3的物质的量浓度不可能为0.2mol/L,温度改变平衡一定发生移动,则NH3的物质的量浓度不可能为0.1mol/L,
故答案为:a、c;
(4)体积缩小压强增大,增大压强平衡向体积减小的反应移动,即向正反应移动;平衡常数只受温度影响,浓度不影响平衡常数,温度不变,平衡常数不变.
故答案为:向正反应方向;不变;
(5)把容器的体积缩小一半的瞬间氨气的浓度,氨气的浓度变为0.20mol/L,8min到达平衡后氨气浓度约为0.25mol/L,故第5分钟末到平衡时NH3浓度的变化曲线为
 ,
,故答案为:
 .
.点评:本题考查化学平衡图象问题,涉及反应速率、平衡常数、化学平衡移动与影响因素等,题目难度中等,注意据此知识的理解掌握,注意同一化学反应中化学平衡常数只与温度有关,与反应物、生成物的浓度无关.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目