题目内容
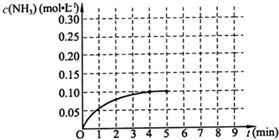
在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图:

(1)该反应的化学平衡常数表达式为
;
(2)根据上图,计算从反应开始到平衡时,平均反应速率v(H2)为
(3)判断该反应达到平衡状态的标志是
a.N2和NH3浓度相等 b.NH3百分含量保持不变
c.容器中气体的压强不变 d.NH3的生成速率与H2的消耗速率相等
e.容器中混合气体的密度保持不变
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
a.0.20mol/L b.0.12mol/Lc.0.10mol/L d.0.08mol/L.

(1)该反应的化学平衡常数表达式为
| [NH3]2 |
| [N2][H2]3 |
| [NH3]2 |
| [N2][H2]3 |
(2)根据上图,计算从反应开始到平衡时,平均反应速率v(H2)为
0.0375 mol/(L?min)
0.0375 mol/(L?min)
.(3)判断该反应达到平衡状态的标志是
b c
b c
(填字母);a.N2和NH3浓度相等 b.NH3百分含量保持不变
c.容器中气体的压强不变 d.NH3的生成速率与H2的消耗速率相等
e.容器中混合气体的密度保持不变
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
a c
a c
.a.0.20mol/L b.0.12mol/Lc.0.10mol/L d.0.08mol/L.
分析:(1)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行计算;
(2)根据v(H2)=
c(NH3)进行计算;
(3)达到平衡状态时,正逆反应速率相等,各物质的浓度不变,百分含量不变等角度分析;
(4)根据反应的可逆性特点以及温度改变平衡一定发生移动进行判断;
(2)根据v(H2)=
| 3 |
| 2 |
(3)达到平衡状态时,正逆反应速率相等,各物质的浓度不变,百分含量不变等角度分析;
(4)根据反应的可逆性特点以及温度改变平衡一定发生移动进行判断;
解答:解:(1)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,应为K=故答案为:K=
;故答案为:
;
(2)根据图象分析平衡时氨气的浓度为0.1mol/L,时间为4min,所以依据速率之比等于系数之比得到:v(H2)=
v(NH3)=
×
=0.0375 mol/(L?min),故答案为:0.0375 mol/(L?min);
(3)a.N2和NH3浓度相等,不能作为判断是否达到平衡的依据,二者浓度关系取决于起始量和反应的程度的关系,故不正确;
b.NH3百分含量保持不变,说明达到平衡状态,故正确;
c.容器中气体的压强不变,说明达到平衡状态,注意如果反应前后的气体的计量数之和相等时,不能作为判断的依据;
d.NH3的生成速率与H2的消耗速率相等时不能说明达到平衡状态,如是NH3的生成速率与H2的生成速率为2:3时可说明达到平衡状态;
e.容器中混合气体的密度保持不变不能作为判断的依据,因为容器的体积不变,气体的质量不变,无论是否达到平衡状态,气体的密度都不变.
故答案为:b、c;
(4)该反应为可逆反应,反应物不可能完全转化,则NH3的物质的量浓度不可能为0.2mol/L,温度改变平衡一定发生移动,则NH3的物质的量浓度不可能为0.1mol/L,故答案为:a、c;
| [NH3]2 |
| [N2][H2]3 |
| [NH3]2 |
| [N2][H2]3 |
(2)根据图象分析平衡时氨气的浓度为0.1mol/L,时间为4min,所以依据速率之比等于系数之比得到:v(H2)=
| 3 |
| 2 |
| 3 |
| 2 |
| 0.1mol/L |
| 4min |
(3)a.N2和NH3浓度相等,不能作为判断是否达到平衡的依据,二者浓度关系取决于起始量和反应的程度的关系,故不正确;
b.NH3百分含量保持不变,说明达到平衡状态,故正确;
c.容器中气体的压强不变,说明达到平衡状态,注意如果反应前后的气体的计量数之和相等时,不能作为判断的依据;
d.NH3的生成速率与H2的消耗速率相等时不能说明达到平衡状态,如是NH3的生成速率与H2的生成速率为2:3时可说明达到平衡状态;
e.容器中混合气体的密度保持不变不能作为判断的依据,因为容器的体积不变,气体的质量不变,无论是否达到平衡状态,气体的密度都不变.
故答案为:b、c;
(4)该反应为可逆反应,反应物不可能完全转化,则NH3的物质的量浓度不可能为0.2mol/L,温度改变平衡一定发生移动,则NH3的物质的量浓度不可能为0.1mol/L,故答案为:a、c;
点评:本题考查化学平衡移动问题,涉及平衡常数、反应速率、平衡标志以及平衡图象等问题,题目难度中等,注意方法性问题的积累.

练习册系列答案
相关题目
 2NH3(g)+Q(Q>0),反应中NH3的物质的量浓度的变化情况如图:
2NH3(g)+Q(Q>0),反应中NH3的物质的量浓度的变化情况如图:

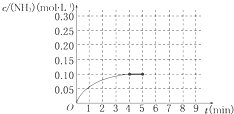 在一容积为2L的密闭容器内为加入 0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0反应中NH3的物质的量浓度的变化的情况如图所示:
在一容积为2L的密闭容器内为加入 0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0反应中NH3的物质的量浓度的变化的情况如图所示: