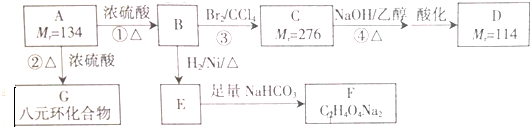
题目内容
5.下列实验操作或实验原理的说法中正确的是( )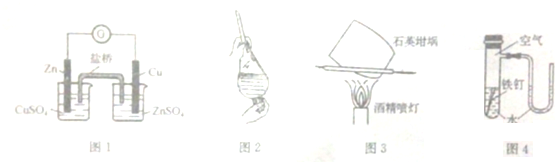
| A. | 用图1装置构成锌--铜原电池 | |
| B. | 用图2装置选择裂化汽油提取溴水中溴 | |
| C. | 用图3装置灼烧碳酸钙制取少量氧化钙 | |
| D. | 用图4装置验证在该条件下铁钉发生吸氧腐蚀 |
分析 A.左烧杯中发生Zn与硫酸铜的置换反应,不能构成原电池;
B.裂化汽油可与溴水发生加成反应;
C.石英坩埚加热时与CaO反应;
D.Fe失去电子,中性环境中氧气得到电子.
解答 解:A.左烧杯中发生Zn与硫酸铜的置换反应,不能构成原电池,应将两个烧杯中电解质互换可构成原电池,故A错误;
B.裂化汽油可与溴水发生加成反应,不能发生萃取,可利用直馏汽油萃取,故B错误;
C.石英坩埚加热时与CaO反应,不能用图中装置灼烧碳酸钙制取少量氧化钙,故C错误;
D.Fe失去电子,中性环境中氧气得到电子,则装置验证在该条件下铁钉发生吸氧腐蚀,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及原电池、有机物的结构与性质、无机物的性质等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验装置的作用及实验评价性分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列各组物质中互为同分异构体的是( )
| A. | 丙醛和丙酮 | B. | 乙醇和乙醚 | ||
| C. | 己烷和环己烷 | D. | 邻甲基苯酚和苯甲醇 |
16.下列叙述中,错误的是( )
| A. | 离子化合物中可能含有非极性键 | |
| B. | 原子晶体中分子间作用力越强,熔点越高 | |
| C. | 原子晶体中可能含有非极性键 | |
| D. | 氯化钠晶体熔化时离子键发生断裂 |
6.利用生产磷铵[(NH4)3P04]排放的废渣磷灰石[(Ca3(P04)2)]制取硫酸并联产水泥的工艺流程如下:
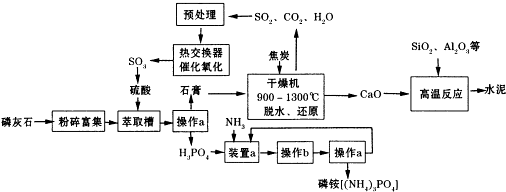
(1)D操作a的名称过滤,实验室中进行此操作时用到的玻璃仪器有漏斗、玻璃棒、烧杯
(2)在实验室中操作b包括蒸发结晶、冷却结晶.
(3)干燥机中发生反应的化学方程式为2CaSO4•2H2O+C$\frac{\underline{\;高温\;}}{\;}$ 2CaO+2SO2↑+CO2↑+4H2O.
(4)水泥常用做建筑材料,是利用了水泥的水硬性性质.
(5)SO2的催化氧化反应为2SO2(g)十02(g)?2S03(g).实验测得压强及温度对S02转化率的影响如下表(原料气各成分的体积分数为SO2:7%、02:11%、N2:82%).
①实际生产中,S02的催化氧化反应是在常压、400℃-500℃条件下进行.采用常压的主要原因是常压下SO2的转化率已经很高,且增大压强时SO2的转化率提高不多,但成本增加较多;该反应化学平衡常数大小关系是:K(400℃)>K(500℃)(填“>”、“<”或“=”).
②催化氧化时使用热交换器的原因是移去反应中放出的热量,使反应后的气体降温并预热未反应的气体.
(6)制硫酸所产生的尾气除了含有N2、02外,还含有SO2、微量的S03和酸雾.下列能用于测定硫酸尾气中SO2含量的试剂组是CD.(填写相应字母)
a、NaOH溶液、酚酞试液 b、Na2CO3溶液、酚酞试液 c、碘水、淀粉溶液 d、KMn04溶液、稀硫酸.

(1)D操作a的名称过滤,实验室中进行此操作时用到的玻璃仪器有漏斗、玻璃棒、烧杯
(2)在实验室中操作b包括蒸发结晶、冷却结晶.
(3)干燥机中发生反应的化学方程式为2CaSO4•2H2O+C$\frac{\underline{\;高温\;}}{\;}$ 2CaO+2SO2↑+CO2↑+4H2O.
(4)水泥常用做建筑材料,是利用了水泥的水硬性性质.
(5)SO2的催化氧化反应为2SO2(g)十02(g)?2S03(g).实验测得压强及温度对S02转化率的影响如下表(原料气各成分的体积分数为SO2:7%、02:11%、N2:82%).
| 压强/Mpa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
②催化氧化时使用热交换器的原因是移去反应中放出的热量,使反应后的气体降温并预热未反应的气体.
(6)制硫酸所产生的尾气除了含有N2、02外,还含有SO2、微量的S03和酸雾.下列能用于测定硫酸尾气中SO2含量的试剂组是CD.(填写相应字母)
a、NaOH溶液、酚酞试液 b、Na2CO3溶液、酚酞试液 c、碘水、淀粉溶液 d、KMn04溶液、稀硫酸.
3.同分异构体现象是有机化学中的一种普便现象,下列有关同分异构体叙述中正确的是( )
| A. | 分子式相同而结构式不同的化合物互称同分异构体 | |
| B. | 组成元素相同而结构式不同的物质互称同分异构体 | |
| C. | 互为同分异构体的物质性质相同 | |
| D. | 互为同分异构体的物质性质相异 |
4.表中的数据是破坏1mol物质中的化学键所消耗的能量(kJ).
根据上述数据回答(1)~(5)题:
(1)下列物质本身具有的能量最低的是A (填A.B.C.D)
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中,最稳定的是A (填A.B.C.D)
A.HF B.HCl C.HBr D.HI
(3)X2+H2=2HX(X代表Cl、Br、I)的反应是放热反应(填“吸热”或“放热”)
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是Cl2(填写分子式).
(5)若无上表中的数据,你能正确回答出问题(4)吗?能.(填能、否)你的根据是元素的非金属性越强,生成物越稳定,放出的热量越多,在这几种HX中,HCl最稳定,放出的热量多.
| 物质 | Cl2 | Br2 | I2 | H2 | HF | HCl HBr HI |
| 能量 | 243 | 193 | 151 | 436 | 568 | 432 366 298 |
(1)下列物质本身具有的能量最低的是A (填A.B.C.D)
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中,最稳定的是A (填A.B.C.D)
A.HF B.HCl C.HBr D.HI
(3)X2+H2=2HX(X代表Cl、Br、I)的反应是放热反应(填“吸热”或“放热”)
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是Cl2(填写分子式).
(5)若无上表中的数据,你能正确回答出问题(4)吗?能.(填能、否)你的根据是元素的非金属性越强,生成物越稳定,放出的热量越多,在这几种HX中,HCl最稳定,放出的热量多.
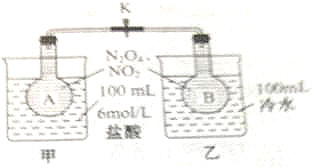 某学校实验小组同学欲探究温度对化学平衡的影响,做如下实验:
某学校实验小组同学欲探究温度对化学平衡的影响,做如下实验: