��Ŀ����
һ���¶���,��һ�ݻ�Ϊ5 L�ĺ����ܱ������г���0.4 mol SO2��0.2 mol O2,������Ӧ:2SO2(g)+O2(g) 2SO3(g) ��H="-196" kJ��mol-1������Ӧ�ﵽƽ��ʱ,������ѹǿ��Ϊ��ʼʱ��0.7������ش���������:
2SO3(g) ��H="-196" kJ��mol-1������Ӧ�ﵽƽ��ʱ,������ѹǿ��Ϊ��ʼʱ��0.7������ش���������:
(1)�жϸ÷�Ӧ�ﵽƽ��״̬�ı�־�� (����ĸ)��
a.SO2��O2��SO3���ߵ�Ũ��֮��Ϊ2��1��2
b.�����������ѹǿ����
c.�����ڻ��������ܶȱ��ֲ���
d.SO3�����ʵ������ٱ仯
e.SO2���������ʺ�SO3�������������
(2)��SO2��ת����Ϊ ;�ڴﵽƽ��ʱ��Ӧ�ų�������Ϊ ;�۴��¶��¸÷�Ӧ��ƽ�ⳣ��K= ��
(3)��ͼ��ʾƽ��ʱSO2�����������ѹǿ���¶ȱ仯������,��: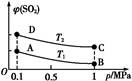
���¶ȹ�ϵ:T1 T2(���������������=��,��ͬ);
��ƽ�ⳣ����ϵ:KA KB,KA KD��
(1)b��d��e (2)��90% ��35.28 kJ ��20 250
(3)�٣� ��= ��
����

��ҵ�Ϻϳɰ��ķ�Ӧ��N2(g)��3H2(g)  2NH3(g)��H����92.60 kJ��mol��1��
2NH3(g)��H����92.60 kJ��mol��1��
��1���ھ��ȡ��ݻ��̶����ܱ������з�����Ӧ��N2(g)��3H2(g)  2NH3(g)������˵����˵��������Ӧ������Ӧ������е���________(�����)��
2NH3(g)������˵����˵��������Ӧ������Ӧ������е���________(�����)��
�ٵ�λʱ��������2n mol NH3��ͬʱ����3n mol H2
�ڵ�λʱ��������6n mol N��H����ͬʱ����2n mol H��H��
����N2��H2��NH3�����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ����֮��Ϊ1��3��2
�ܻ�������ƽ��Ħ����������
�������ڵ������ܶȲ���
��2����֪�ϳɰ���Ӧ��ij�¶���2 L���ܱ������н��У�����������ݣ�
| ʱ��(h) ���ʵ���(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | | 1.00 | 1.00 |
���ݱ������ݼ��㣺
�ٷ�Ӧ���е�2 hʱ�ų�������Ϊ________ kJ��
��0��1 h��N2��ƽ����Ӧ����Ϊ________ mol��L��1��h��1��
�۴��¶��¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K��________(������λС��)��
�ܷ�Ӧ�ﵽƽ�������ƽ����ϵ���ټ���N2��H2��NH3��1.00 mol����ѧƽ�⽫��________�����ƶ�(�����Ӧ�����淴Ӧ��)��
��һ���������İ�������粒����������Ƶ��ܱ���������У���������������䣬��������������Բ��ƣ����ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺NH2COONH4��s��  2NH3��g����CO2��g��
2NH3��g����CO2��g��
ʵ���ò�ͬ�¶��µ�ƽ�����������±���
| �¶�/�� | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| ƽ����ѹ ǿ/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| ƽ��������Ũ��/mol�� L��1 | 2.4�� 10��3 | 3.4�� 10��3 | 4.8�� 10��3 | 6.8�� 10��3 | 9.4�� 10��3 |
��1�������жϸ÷ֽⷴӦ�Ѿ��ﵽƽ�����________��
A��2v��NH3����v��CO2��
B���ܱ���������ѹǿ����
C���ܱ������л��������ܶȲ���
D���ܱ������а����������������
��2�����ݱ������ݣ���ʽ����25.0 ��ʱ�ķֽⷴӦƽ�ⳣ����_______________��
��3��ȡһ�����İ�������粒������һ�����������ܱ���������У���25.0 ���´ﵽ�ֽ�ƽ�⡣���ں�����ѹ�������������������粒����������________������ӡ��������١����䡱����
(1)��100 ����������½�0.100 mol��N2O4�������Ϊ1 L������ܱ������У�������Ӧ��N2O4(g) 2NO2(g)����H��0����һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ�
2NO2(g)����H��0����һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ�
| t/s c/(mol��L��1)���� | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol��L��1) | 0.100 | a | 0.5b | 0.4b | | |
| c(NO2)/(mol��L��1) | 0 | 0.060 | b | c1 | c2 | c3 |
��ش��������⣺
�ٱ���a��________����0��20 s��N2O4��ƽ����Ӧ����Ϊ_______mol��(L��s)��1��
����֪100 ��ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ0.36�������b��c1��c2�Ĵ�С��ϵΪ________��c3��________mol��L��1���ﵽƽ��ʱN2O4��ת����Ϊ________________________________��
(2)�����£���SiO2ϸ�۷�������ˮ�У����Ͻ��裬���γ�H4SiO4��Һ����Ӧԭ�����£�
SiO2(s)��2H2O(l)??H4SiO4(aq)����H
��д���÷�Ӧ�Ļ�ѧƽ�ⳣ��K�ı���ʽ��____________________________��
��ʵ���ϣ��ڵ�����������ѹǿ�ܴ��塢Һ�嶼���ܵ�Ӱ�졣��һ���¶��£���10 000 m���µĵ������������Ӧ�ķ�����________(����������淽���ƶ���)��������_______________________________��
������̶����ܱ������У��������»�ѧ��Ӧ��N2O4��g�� 2NO2��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
2NO2��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
| t /�� | 80 | 100 | 120 |
| K | 1.80 | 2.76 | 3.45 |
��ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK�� ��
��2���÷�ӦΪ ��Ӧ������ȡ����ȡ�����
��3���жϸ÷�Ӧ�ﵽ��ѧƽ��״̬�������� ��
A�������ڻ�������ܶȲ���
B�����������c��NO2������
C��0.5mol N2O4�ֽ��ͬʱ��1 mol NO2����
��4����80��ʱ����2.80molN2O4�������2L�̶��ݻ����ܱ������У�һ��ʱ���Ը������ڵ����ʽ��з������õ��������ݣ�
  | 0 | 20 | 40 | 60 | 80 | 100 |
| n��N2O4�� | 2.80 | A | 2.00 | c | d | 1.60 |
| n��NO2�� | 0 | 0.96 | b | 2.08 | 2.40 | 2.40 |
��b��ֵΪ ��
��N2O4��ƽ��ת����Ϊ ��
��20s��40s����N2O4��ʾ��ƽ����Ӧ���ʦԣ�N2O4���� ��
 2C(g)����H<0����Ӧ��ƽ�����ƽ�ⳣ��ΪK����ʱA��ת����Ϊx��
2C(g)����H<0����Ӧ��ƽ�����ƽ�ⳣ��ΪK����ʱA��ת����Ϊx��
 2CO(g)����H>0,���������CO2�����ʵ�����ʱ��t�ı仯��ϵ��ͼ��ʾ��
2CO(g)����H>0,���������CO2�����ʵ�����ʱ��t�ı仯��ϵ��ͼ��ʾ��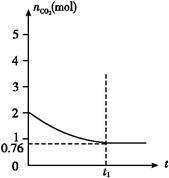
 Fe(s)+CO2(g)��H��0����֪1 373 KʱK=0.263��
Fe(s)+CO2(g)��H��0����֪1 373 KʱK=0.263�� �����Ṥҵ�е���Ҫ��Ӧ�����SO2��ƽ��ת���������ڼ���β���ŷţ���֪�÷�Ӧ�Ƿ��ȷ�Ӧ�����÷�Ӧ����ƽ��״̬ʱ��Ϊ�����SO2��ת���ʣ����пɲ��õĴ�ʩ��
�����Ṥҵ�е���Ҫ��Ӧ�����SO2��ƽ��ת���������ڼ���β���ŷţ���֪�÷�Ӧ�Ƿ��ȷ�Ӧ�����÷�Ӧ����ƽ��״̬ʱ��Ϊ�����SO2��ת���ʣ����пɲ��õĴ�ʩ�� B��������ѹǿ���ֲ��䣮
B��������ѹǿ���ֲ��䣮 D�����������ʵ��ܶȱ��ֲ��䣮
D�����������ʵ��ܶȱ��ֲ��䣮