题目内容
18.写出符合下列离子方程式对应的一个化学方程式①H++OH-=H2OHCl+NaOH=NaCl+H2O
②Ag++Cl-=AgCl↓AgNO3+NaCl=NaNO3+AgCl↓.
分析 ①H++OH-=H2O可表示强酸与强碱反应生成可溶性盐和水的反应;
②Ag++Cl-=AgCl↓可表示硝酸银与盐酸或氯化钠等物质的反应.
解答 解:①H++OH-=H2O可表示强酸与强碱反应生成可溶性盐和水的反应,如HCl+NaOH=NaCl+H2O等,故答案为:HCl+NaOH=NaCl+H2O;
②Ag++Cl-=AgCl↓可表示硝酸银与盐酸或氯化钠等物质的反应,如AgNO3+NaCl=NaNO3+AgCl↓,故答案为:AgNO3+NaCl=NaNO3+AgCl↓.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应考查,注意离子反应中保留化学式的物质及离子反应方程式的意义,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.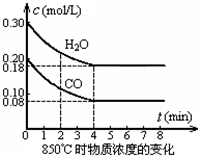 (1)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
(1)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g)?CO2(g)+H2(g)△H<0
CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)=0.03mol/(L•min)
(2)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表:
①表中3min~4min之间反应处于平衡状态;C1数值大于0.08mol/L(填大于、小于或等于).
②反应在4min~5min问,平衡向逆方向移动,可能的原因是D(单选),表中5min~6min之间数值发生变化,可能的原因是A(单选).
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度.
 (1)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
(1)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0
CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)=0.03mol/(L•min)
(2)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表:
| 时间(min) | 0 | 2 | 3 | 4 | 5 | 6 |
| CO | 0.200 | 0.138 | C1 | C1 | 0.116 | 0.096 |
| H2O | 0.300 | 0.238 | C2 | C2 | 0.216 | 0.266 |
| CO2 | 0 | 0.062 | C3 | C3 | 0.084 | |
| H2 | 0 | 0.062 | C3 | C3 | 0.104 |
②反应在4min~5min问,平衡向逆方向移动,可能的原因是D(单选),表中5min~6min之间数值发生变化,可能的原因是A(单选).
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度.
6.在一密闭容器中,反应m A(g)+n B(g)?3C(g)达到平衡时,测得c(A)=0.5mol/L.在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)=0.2mol/L.下列判断中正确的是( )
| A. | A的质量分数增加 | B. | 平衡不移动 | ||
| C. | 化学计量数:m+n=3 | D. | 物质C的体积分数增加 |
3.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 32gO2中含有的分子数为NA | |
| B. | 标准状况下,22.4L H2O中含有的分子数为NA | |
| C. | 1mol Mg与足量O2反应转移的电子数为NA | |
| D. | 1L 1mol•L-1 CaCl2溶液中含有的氯离子数为NA. |
10.雷雨天闪电时空气中有臭氧(O3)生成,下列说法中正确的是( )
| A. | O2和O3互为同素异形体 | |
| B. | O3是由3个氧原子构成的化合物 | |
| C. | O2和O3相互转化属于化学变化 | |
| D. | 等质量的O2和O3含有的氧原子数相同 |
7.对一些具有危险的化学物质,若要在其包装上贴危险化学品标记,下列标签贴错的是( )
| A. |  浓硫酸 | B. |  汽油 | C. |  KClO3 | D. |  乙醇 |
8.化学与科学发展、生产、生活密切相关.下列有关说法中错误的是( )
| A. | “碳纳米泡沫”被称为第五形态的单质碳,与石墨互为同素异形体 | |
| B. | “神七”飞船返回仓的绝热层所使用的是耐高温、抗氧化的新型材料 | |
| C. | 卫生部公布的首批非法食品添加剂中的三聚氰胺是一种含氮量很高的蛋白质 | |
| D. | 陶瓷、玻璃、水泥是使用量最大的无机非金属材料,都属于硅酸盐产品 |
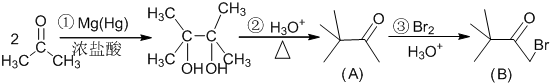
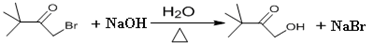 .
.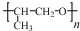 ,则该同分异构体的结构简式为:
,则该同分异构体的结构简式为: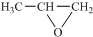 .
.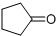 )来代替丙酮,连续发生上述路线中反应①、②之后,得到的有机产物的结构简式为:
)来代替丙酮,连续发生上述路线中反应①、②之后,得到的有机产物的结构简式为: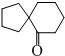 .
.