题目内容
欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3-)都减少
| A.通入二氧化碳气体 | B.加入氢氧化钠固体 |
| C.通入氯化氢气体 | D.加入饱和石灰水溶液 |
D
试题分析:在NaHCO3溶液中存在电离平衡:HCO3-
 CO32-+ H+。A.通入二氧化碳气体,会发生反应:CO2+ CO32-+H2O="2" HCO3-;所以c(CO32-)会减小,c(HCO3-)会增大。错误。B.加入氢氧化钠固体,由于OH-会中和H+,使c(H+)减小,电离平衡正向移动,c(CO32-)增大,c(HCO3-)减小,不符合题意。错误。C.通入氯化氢气体,HCl溶于水,电离产生H+,使溶液中的c(H+)增大,电离平衡逆向移动,c(CO32-)减小,c(HCO3-)增大,不符合题意。错误。D.加入饱和石灰水溶液,会发生反应:Ca(OH)2+ NaHCO3=CaCO3↓+NaOH+H2O,溶液中c(H+)、c(CO32-)、c(HCO3-)都减少.符合题意。正确。
CO32-+ H+。A.通入二氧化碳气体,会发生反应:CO2+ CO32-+H2O="2" HCO3-;所以c(CO32-)会减小,c(HCO3-)会增大。错误。B.加入氢氧化钠固体,由于OH-会中和H+,使c(H+)减小,电离平衡正向移动,c(CO32-)增大,c(HCO3-)减小,不符合题意。错误。C.通入氯化氢气体,HCl溶于水,电离产生H+,使溶液中的c(H+)增大,电离平衡逆向移动,c(CO32-)减小,c(HCO3-)增大,不符合题意。错误。D.加入饱和石灰水溶液,会发生反应:Ca(OH)2+ NaHCO3=CaCO3↓+NaOH+H2O,溶液中c(H+)、c(CO32-)、c(HCO3-)都减少.符合题意。正确。
练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
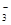 )+c(H2CO3)
)+c(H2CO3)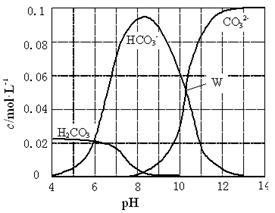
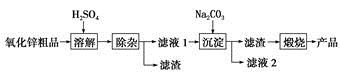
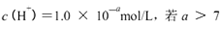 时,则该溶液的pH一定为14-a
时,则该溶液的pH一定为14-a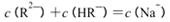
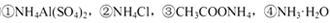 溶液中,c (NH4+)由大到小的顺序是:①>②>③>④
溶液中,c (NH4+)由大到小的顺序是:①>②>③>④