题目内容
6.下列物质既含有离子键又含有共价键的是( )| A. | NaCl | B. | CO2 | C. | NaOH | D. | K2O2 |
分析 一般来说,金属元素与非金属元素形成离子键,非金属元素之间形成共价键,以此来解答.
解答 解:A.NaCl中只含离子键,故A不选;
B.二氧化碳中只含共价键,故B不选;
C.NaOH中含离子键和O-H共价键,故C选;
D.过氧化钾中含离子键和O-O共价键,故D选;
故选CD.
点评 本题考查化学反应与化学键,为高频考点,把握化学键判断的一般规律、物质中的化学键即可解答,题目难度不大.

练习册系列答案
相关题目
16.在容积可变的密闭容器中,2molN2和8molH2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时氮气的转化率近于( )
| A. | 20% | B. | 25% | C. | 33% | D. | 35% |
17.下列说法正确的是( )
| A. | 同一周期,从左到右,第一电离能逐渐增大 | |
| B. | 第一电离能越大,金属性越强 | |
| C. | 第三周期,从左到右,主族元素电负性逐渐增大 | |
| D. | 电负性越大,原子半径越大 |
14.某有机物分子式为C2H4O2,且能跟NaOH溶液反应,则下列说法中不正确的是( )
| A. | 该有机物可能是羧酸 | |
| B. | 该有机物可能是酯 | |
| C. | 该有机物可能含有碳碳双键 | |
| D. | 将该有机物和CH4混合,共5mol,完全燃烧,共消耗10mol O2 |
11.有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
回答下列问题:
(1)写出下列元素的名称:B、氧,C、钠,D、铝,E、氯;
(2)写出A、B、C形成的化合物M的电子式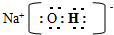 ;
;
(3)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键;
(4)E单质与M的水溶液反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构, 且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(1)写出下列元素的名称:B、氧,C、钠,D、铝,E、氯;
(2)写出A、B、C形成的化合物M的电子式
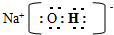 ;
;(3)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键;
(4)E单质与M的水溶液反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
18.a LFeSO4溶液中含Fe2+bg,将aL上述溶液稀释为原来3倍,则所得溶液中SO42-的物质的量浓度为( )mol/L.
| A. | $\frac{56b}{a}$ | B. | $\frac{b}{168a}$ | C. | $\frac{3b}{168a}$ | D. | $\frac{b}{56a}$ |
15.NA表示阿伏加德罗常数的值,下列说法错误的是( )
| A. | 含0.1NA个 H的H2O中,O的质量为0.8g | |
| B. | 0.012kg C所含的C数为NA | |
| C. | 98g H2SO4溶于2L水,取其中500mL,溶液中c(H+)为1mol/L | |
| D. | 通常状况下,1mol H2O的体积小于22.4L |
16.关于氧化还原反应的说法中正确的是( )
| A. | 所含元素化合价升高的物质是还原剂 | |
| B. | 氧化剂失去电子,所含元素的化合价升高 | |
| C. | 作氧化剂的物质不能作还原剂 | |
| D. | 化合价降低,失去电子的物质是还原剂 |
 .
.