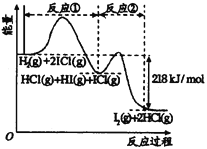
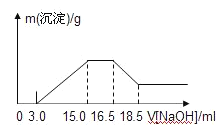
题目内容
【题目】能证明SO2具有漂白性的是( )
A.酸性![]() 溶液中通入
溶液中通入![]() 气体后紫红色消失
气体后紫红色消失
B.滴有酚酞的NaOH溶液中通入![]() 气体后红色消失
气体后红色消失
C.品红溶液中通入![]() 气体后红色消失
气体后红色消失
D.溴水中通入![]() 气体后橙色消失
气体后橙色消失
【答案】C
【解析】
A.SO2通入紫色的酸性KMnO4溶液中,发生氧化还原反应,紫色褪去,体现二氧化硫的还原性,故不选A;
B.滴有酚酞的NaOH溶液中通入SO2气体红色消失,因为二氧化硫与氢氧化钠发生反应生成亚硫酸钠和水,体现其酸性氧化物性质,故不选B;
C.SO2通入品红溶液中,红色褪去,二氧化硫与品红化合生成无色物质,体现二氧化硫的漂白性,故选C;
D.SO2通入溴水中橙色褪去,发生氧化还原反应生成硫酸和氢溴酸,体现二氧化硫的还原性,故不选D;
选C。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】利用催化技术可将汽车尾气中的 NO 和 CO 转变成 CO2 和 N2,化学方程式:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。某温度下,在容积不变的密闭容器中通入 NO 和 CO,测得不同时间的 NO 和 CO 的浓度如表:
2CO2(g)+N2(g)。某温度下,在容积不变的密闭容器中通入 NO 和 CO,测得不同时间的 NO 和 CO 的浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/×10-3mol/L | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
c(CO)/×10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
下列说法中不正确的是( )
A. 2 s 内的平均反应速率 v(N2)=1.875×10-4 mol·L-1·s-1
B. 在该温度下,反应的平衡常数 K=5
C. 若将容积缩小为原来的一半,NO 转化率大于 90%
D. 使用催化剂可以提高单位时间内 CO 和 NO 的处理量
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g),已知下列化学键的键能:
2NH3(g),已知下列化学键的键能:
化学键 | 键能kJ/mol |
H-H | 436 |
N-H | 391 |
N | 946 |
下列说法正确的是
A. 该反应为吸热反应B. 该反应中反应物的总能量高于生成物的总能量
C. 反应热ΔH=92 kJ·mol-1D. 生成1 mol NH3放出92 kJ热量