题目内容
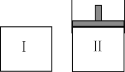
【题目】在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是
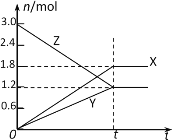
A.该反应的化学方程式为:3X+2Y![]() 2Z
2Z
B.若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间大于t0
C.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态
D.若达平衡后,对容器Ⅱ升高温度时其体积增大,说明Z发生的反应为吸热反应
【答案】BC
【解析】
根据X、Y、Z物质的量的变化图象分析计算得到化学方程式;根据计算得到的化学方程式的反应特点分析,Ⅰ是恒容容器,II是恒压容器;两容器中Z的物质的量分数相同说明达到相同的平衡状态;升高温度平衡向吸热方向进行。据此分析。
A.根据X、Y、Z物质的量的变化图象分析,Z是反应物,X、Y是生成物,平衡后,X生成1.8mol,Y生成1.2mol,Z反应1.8mol,则反应的化学方程式为:3Z![]() 3X+2Y,A错误;
3X+2Y,A错误;
B.反应的化学方程式3Z![]() 3X+2Y,若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器容器Ⅱ达到平衡时体积增大、压强减小,达到平衡所需时间大于t0,B正确;
3X+2Y,若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器容器Ⅱ达到平衡时体积增大、压强减小,达到平衡所需时间大于t0,B正确;
C.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,说明达到相同的平衡,不受压强的变化影响,所以反应前后气体分子数相等,则Y为固态或液态,C正确;
D.若达平衡后,容器Ⅱ是恒压容器,升高温度时其体积增大,但不能平衡正向进行, Z发生的反应不一定为吸热反应,D错误;
答案选BC。

练习册系列答案
相关题目