题目内容
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42—等杂质,提纯工艺线路如图所示:
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:

Ⅱ.有关物质的溶度积如下
回答下列问题:
(1)加入NaOH溶液时,反应的离子方程式为 。向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)= 。
(2)“母液”中除了含有Na+、CO32—外,还含有 等离子。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线进行循环使用。请你分析在实际工业生产中是否可行: (填“可行”或“不可行”),并说明理由: 。
(4)已知:Na2CO3·10H2O(s) Na2CO3(s)+10H2O(g)
Na2CO3(s)+10H2O(g) ="+532.36" kJ·mol-1
="+532.36" kJ·mol-1
Na2CO3·10H2O(s) Na2CO3·H2O(s)+9H2O(g)
Na2CO3·H2O(s)+9H2O(g)  ="+473.63" kJ·mol-1
="+473.63" kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式: 。

Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:

Ⅱ.有关物质的溶度积如下
| 物质 | CaCO3 | MgCO3 | Ca(0H)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液时,反应的离子方程式为 。向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)= 。
(2)“母液”中除了含有Na+、CO32—外,还含有 等离子。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线进行循环使用。请你分析在实际工业生产中是否可行: (填“可行”或“不可行”),并说明理由: 。
(4)已知:Na2CO3·10H2O(s)
 Na2CO3(s)+10H2O(g)
Na2CO3(s)+10H2O(g) ="+532.36" kJ·mol-1
="+532.36" kJ·mol-1Na2CO3·10H2O(s)
 Na2CO3·H2O(s)+9H2O(g)
Na2CO3·H2O(s)+9H2O(g)  ="+473.63" kJ·mol-1
="+473.63" kJ·mol-1写出Na2CO3·H2O脱水反应的热化学方程式: 。
(1)MgCO3+2OH- = Mg(OH)2+ CO32—(书写Fe3++3 OH-=Fe(OH)3↓、Mg2++2 OH-=Mg(OH)2↓不得分)(3分)
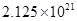 (3分)(2)Cl-、
(3分)(2)Cl-、 (2分)
(2分)(3)不可行(2分) 若“母液”循环使用,则溶液中c(Cl-)和c(
 )增大,最后所得产物Na2CO3混有杂质(2分)
)增大,最后所得产物Na2CO3混有杂质(2分)(4)Na2CO3·H2O(s)=Na2CO3(s)+ H2O(g) △H="+58.73" kJ·mol-1 (3分)
试题分析:由溶度积表知,MgCO3的Ksp最大,在溶液中溶解的最多,其它物质与MgCO3相差的数量级较大,在溶液里可以忽略。
(1)主要是MgCO3与NaOH的反应生成Ksp更小的沉淀Mg(OH)2;
PH="8" ,C OH-=10-6 Ksp= c(Mg2+)C2(OH-)= c(Mg2+)10-12 =5.61×10-12 c(Mg2+)=5.61
Ksp= c(Fe3+)C3(OH-)=c(Fe3+)10-18=2.64×10-39 c(Fe3+)=2.64×10-21
c(Mg2+):c(Fe3+)=5.61:2.64×10-21=
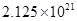
(2)母液”中,与CO32—不形成沉淀的只有Cl-、

(4)①Na2CO3·10H2O(s)
 Na2CO3(s)+10H2O(g)
Na2CO3(s)+10H2O(g) ="+532.36" kJ·mol-1
="+532.36" kJ·mol-1②Na2CO3·10H2O(s)
 Na2CO3·H2O(s)+9H2O(g)
Na2CO3·H2O(s)+9H2O(g)  ="+473.63" kJ·mol-1
="+473.63" kJ·mol-1①-②得:Na2CO3·H2O(s)=Na2CO3(s)+ H2O(g) △H="+58.73" kJ·mol-1sp计算、离子共存、盖斯定律等相关知识。

练习册系列答案
相关题目
 CH3OH(g);ΔH=-90.8kJ·mol
CH3OH(g);ΔH=-90.8kJ·mol
 H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
 CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。现在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。下列说法正确的是
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。现在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。下列说法正确的是
 N2(g)+CO2(g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
 2CO2+ N2 △H
2CO2+ N2 △H


 2SO3(g)的平衡常数为 。
2SO3(g)的平衡常数为 。




 )。
)。