题目内容
【题目】我国具有悠久的历史,在西汉就有湿法炼铜![]() ,试回答下列问题。
,试回答下列问题。
![]() 基态铜原子最外层电子所占用能级的电子云轮廓图形状为______。
基态铜原子最外层电子所占用能级的电子云轮廓图形状为______。
![]() 黄铁矿
黄铁矿![]() 主要成分
主要成分![]() 是提取硫和制造硫酸的主要矿物原料,产物氧化铁也可以用于炼铁,写出
是提取硫和制造硫酸的主要矿物原料,产物氧化铁也可以用于炼铁,写出![]() 的电子式______。
的电子式______。
![]() 金属铜广泛地应用于电气、机械制造、国防等领域。
金属铜广泛地应用于电气、机械制造、国防等领域。
![]() 受热易分解为
受热易分解为![]() 和
和![]() ,请从铜的原子结构来说明CuO受热易分解的原因:_________
,请从铜的原子结构来说明CuO受热易分解的原因:_________
![]() 向氯化铜溶液中加入过量浓氨水,然后加入适量乙醇,溶液中析出深蓝色的
向氯化铜溶液中加入过量浓氨水,然后加入适量乙醇,溶液中析出深蓝色的![]() 晶体。上述深蓝色晶体中含有的化学键除普通共价键外,还有______和______。
晶体。上述深蓝色晶体中含有的化学键除普通共价键外,还有______和______。
![]() 在硫酸铜溶液中加入过量KCN,生成配离子
在硫酸铜溶液中加入过量KCN,生成配离子![]() ,则1mol该配离子中含有的
,则1mol该配离子中含有的![]() 键的数目为_______。
键的数目为_______。
![]() 的盐酸溶液能吸收CO而生成复合物氯化羰基亚铜
的盐酸溶液能吸收CO而生成复合物氯化羰基亚铜![]() 该反应的化学方程式为______,氯化羰基亚铜结构示意图如图。则该化合物中与
该反应的化学方程式为______,氯化羰基亚铜结构示意图如图。则该化合物中与![]() 形成配位键的原子是______。
形成配位键的原子是______。

![]() 金铜合金的一种晶体结构为立方晶型,如图所示:
金铜合金的一种晶体结构为立方晶型,如图所示:

![]() 该合金的化学式为______;
该合金的化学式为______;
![]() 已知该合金的密度为
已知该合金的密度为![]() ,阿伏加德罗常数值为
,阿伏加德罗常数值为![]() ,两个金原子间最小间隙为
,两个金原子间最小间隙为![]() 。则铜原子的半径为______
。则铜原子的半径为______![]() 写出计算表达式
写出计算表达式![]() 。
。
【答案】球形 ![]()
![]() 的最外层电子排布为
的最外层电子排布为![]() ,而
,而![]() 的最外层电子排布为
的最外层电子排布为![]() ,最外层电子排布达到全满时稳定,所以固态
,最外层电子排布达到全满时稳定,所以固态![]() 稳定性强于CuO 离子键 配位键
稳定性强于CuO 离子键 配位键 ![]()
![]() O、Cl、C
O、Cl、C ![]()

【解析】
![]() 原子最外层电子所占用能级的为4s,电子云轮廓图形状为球形;
原子最外层电子所占用能级的为4s,电子云轮廓图形状为球形;
![]() 由
由![]() 与
与![]() 构成,
构成,![]() 与
与![]() 互为等电子体,二者结构相同;
互为等电子体,二者结构相同;
![]() 的最外层电子排布为
的最外层电子排布为![]() ,而
,而![]() 的最外层电子排布为
的最外层电子排布为![]() ,最外层电子排布达到全满时稳定;
,最外层电子排布达到全满时稳定;
![]() 晶体中
晶体中![]() 、
、![]() 形成离子键,
形成离子键,![]() 中
中![]() 与
与![]() 形成配位键,
形成配位键,![]() 中存在普通共价键;
中存在普通共价键;
![]() 中
中![]() 与
与![]() 形成配位键,配位键属于
形成配位键,配位键属于![]() 键,
键,![]() 中含有1个
中含有1个![]() 键;
键;
![]() 的盐酸溶液能吸收CO而生成复合物氯化羰基亚铜
的盐酸溶液能吸收CO而生成复合物氯化羰基亚铜![]() ;
;
![]() 位于顶点、Cu位于面心;
位于顶点、Cu位于面心;
![]() 根据晶胞进行计算。
根据晶胞进行计算。
![]() 原子核外电子排布式为:
原子核外电子排布式为:![]() ,最外层电子所占用能级的为4s,电子云轮廓图形状为:球形;
,最外层电子所占用能级的为4s,电子云轮廓图形状为:球形;
![]() 由
由![]() 与
与![]() 构成,
构成,![]() 与
与![]() 互为等电子体,二者结构相同,
互为等电子体,二者结构相同,![]() 电子式为:
电子式为:![]() ;
;
![]() 的最外层电子排布为
的最外层电子排布为![]() ,而
,而![]() 的最外层电子排布为
的最外层电子排布为![]() ,最外层电子排布达到全满时稳定,所以固态
,最外层电子排布达到全满时稳定,所以固态![]() 稳定性强于CuO;
稳定性强于CuO;
![]() 晶体中/span>
晶体中/span>![]() 、
、![]() 形成离子键,
形成离子键,![]() 中
中![]() 与
与![]() 形成配位键,
形成配位键,![]() 中存在普通共价键,故答案为:离子键、配位键;
中存在普通共价键,故答案为:离子键、配位键;
![]() 中
中![]() 与
与![]() 形成配位键,配位键属于
形成配位键,配位键属于![]() 键,
键,![]() 中含有1个
中含有1个![]() 键,故
键,故![]() 中含有8个
中含有8个![]() 键,则1mol该配离子中含有的
键,则1mol该配离子中含有的![]() 键的数目为
键的数目为![]() ;
;
![]() 的盐酸溶液能吸收CO而生成复合物氯化羰基亚铜
的盐酸溶液能吸收CO而生成复合物氯化羰基亚铜![]() ,该反应的化学方程式为:
,该反应的化学方程式为:![]() ,氯原子、水中O原子均含有孤电子对,与
,氯原子、水中O原子均含有孤电子对,与![]() 形成配位键,CO中C原子、O原子均哈不要孤对电子,由于O的电负性比C的大,C原子提供孤电子对,形成配位键,
形成配位键,CO中C原子、O原子均哈不要孤对电子,由于O的电负性比C的大,C原子提供孤电子对,形成配位键,
故答案为:![]() ;O、Cl、C;
;O、Cl、C;
![]() 位于顶点、Cu位于面心,晶胞中Au原子数目
位于顶点、Cu位于面心,晶胞中Au原子数目![]() 、Cu原子数目
、Cu原子数目![]() ,故化学式
,故化学式![]() ;
;
![]() 晶胞质量
晶胞质量![]() ,晶胞体积
,晶胞体积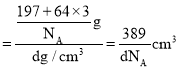 ,则晶胞棱长
,则晶胞棱长![]() ,晶胞棱长
,晶胞棱长![]() 原子之间最小间隙距离
原子之间最小间隙距离![]() 原子直径,故Au原子直径
原子直径,故Au原子直径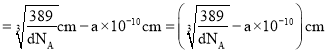 ,晶胞面对角线长度等于晶胞棱长的
,晶胞面对角线长度等于晶胞棱长的![]() 倍,则晶胞面对角线长度
倍,则晶胞面对角线长度 ,而晶胞面对角线长度
,而晶胞面对角线长度![]() 原子直径
原子直径![]() 原子直径,故Cu原子直径
原子直径,故Cu原子直径 ,故Cu原子半径
,故Cu原子半径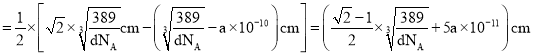 。
。

 名师点拨卷系列答案
名师点拨卷系列答案【题目】工业上,在一定条件下利用乙烯和水蒸气反应制备乙醇。反应原CH2=CH2(g)+H2O(g)=CH3CH2OH(g )△H。已知几种共价键的键能如下:
化学键 | C-H | C=C | H-O | C-C | C-O |
键能/kJ·mol-1 | 413 | 615 | 463 | 348 | 351 |
下列说法错误的是
A. 上述合成乙醇的反应原子利用率为100%
B. 相同时间段内,用该反应中三种物质表示的该反应的化学反应速率相等
C. 碳碳双键的键能大于碳碳单键键能,但碳碳单键更稳定
D. 上述反应式中,△H=+34kJ·mol-1
【题目】(1)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为_____。又已知:H2O(g)=H2O(l);△H2=﹣44.0kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是___kJ。
(2)已知:2NO2(g)═N2O4(g) △H1 2NO2(g)═N2O4(l) △H2,下列能量变化示意图中,正确的是(选填字母)______。
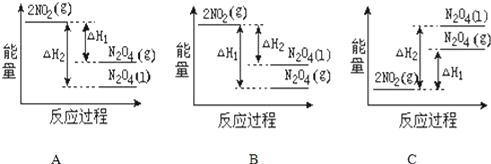
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)═CO2(g) △H1=﹣393.5kJmol﹣1
2H2(g)+O2(g)═2H2O(l) △H2=﹣571.6kJmol﹣1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l) △H3=﹣2 599kJmol﹣1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:__。
(4)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇气体(结构简式为CH3OH)。已知某些化学键的键能数据如表:
化学键 | C﹣C | C﹣H | H﹣H | C﹣O | C≡O | H﹣O |
键能/kJmol﹣1 | 348 | 413 | 436 | 358 | 1072 | 463 |
已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为_______。