题目内容
【题目】(1)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为_____。又已知:H2O(g)=H2O(l);△H2=﹣44.0kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是___kJ。
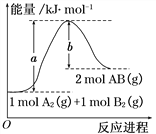
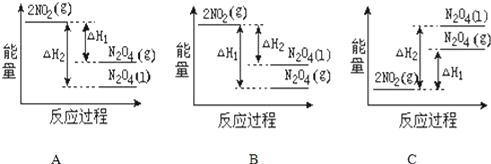
(2)已知:2NO2(g)═N2O4(g) △H1 2NO2(g)═N2O4(l) △H2,下列能量变化示意图中,正确的是(选填字母)______。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)═CO2(g) △H1=﹣393.5kJmol﹣1
2H2(g)+O2(g)═2H2O(l) △H2=﹣571.6kJmol﹣1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l) △H3=﹣2 599kJmol﹣1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:__。
(4)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇气体(结构简式为CH3OH)。已知某些化学键的键能数据如表:
化学键 | C﹣C | C﹣H | H﹣H | C﹣O | C≡O | H﹣O |
键能/kJmol﹣1 | 348 | 413 | 436 | 358 | 1072 | 463 |
已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为_______。
【答案】B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)△H=-2165kJ/mol 1016.5 A +226.7kJmol﹣1 CO(g)+2H2(g)CH3OH(g) △H=﹣116 kJ/mol
【解析】
(1)0.3mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量,则1mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出热量为2165kJ的热量,根据盖斯定律写出其热化学反应方程式,并根据物质的物质的量与反应放出的热量成正比来解答;
(2)降低温度,将NO2(g)转化为N2O4(l)说明反应2NO2(g)N2O4(l)为放热反应,同种物质液态时能量比气态时能量低;
(3)根据盖斯定律,将已知的三个热化学方程式叠加,可得待求反应的热化学方程式;
(4)依据化学反应焓变=反应物键能总和-生成物键能总和计算,标注物质聚集状态和对应反应的焓变写出热化学方程式。
(1)0.3mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量,则1mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出2165kJ的热量,反应的热化学方程式为:B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=﹣2165kJ/mol;
①B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=﹣2165kJ/mol
②H2O(g)=H2O(l);△H2=﹣44.0kJ/mol,
由盖斯定律可知①+②×3得:B2H6(g)+3O2(g)═B2O3(s)+3H2O(g)△H=-2033kJ/mol,则(11.2L标准状况)即0.5mol乙硼烷完全燃烧生成气态水时放出的热量是2033kJ×0.5=1016.5kJ;
(2)降低温度,NO2(g)转化为N2O4(l)说明反应2NO2(g)N2O4(l)为放热反应,同种物质液态时能量比气态时能量低,所以在图象中该反应的反应物的总能量比生成物的总能量高,同种物质气态变液态会放出热量,即液态时能量比气态时能量低,则N2O4(l)具有的能量比N2O4(g)具有的能量低,图象A符合;
(3已知:①C(s,石墨)+O2(g)═CO2(g) △H1=﹣393.5kJmol﹣1
②2H2(g)+O2(g)═2H2O(l) △H2=﹣571.6kJmol﹣1
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l) △H3=﹣2 599kJmol﹣1
根据盖斯定律,①×4+②-③得到反应的热化学方程式为:4C(s,石墨)+2H2(g)=2C2H2(g)
△H=(4△H1+△H2-△H3)=+453.4kJ/mol;所以热化学方程式为:2C(s,石墨)+H2(g)=C2H2(g) △H=![]() (4△H1+△H2-△H3)=
(4△H1+△H2-△H3)=![]() ×(+453.4kJ/mol)=+226.7kJ/mol;
×(+453.4kJ/mol)=+226.7kJ/mol;
(4)CO和H2化合来制备甲醇气体的方程式CO(g)+2H2(g)CH3OH(g),反应的焓变可以根据反应物的总键能和生成物的总键能计算得到,焓变=反应物总键能之和-生成物总键能之和,依据图表提供的化学键的键能计算得到,△H1=1072kJ/mol+2×436kJ/mol-(3×413kJ/mol+358kJ/mol+463kJ/mol)=-116kJ/mol。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案