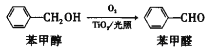题目内容
【题目】元素X位于第四周期,其基态原子有4个未成对电子。Y原子最外层电子数是其内层电子总数的3倍,元素Z基态原子的3p轨道上有4个电子。
(1)Y与Z可形成多种化合物。
① 元素Y与Z中电负性较大的是________(用元素符号描述)。
② 离子ZY32-的空间构型为________(用文字描述)。
③ 写出一种与ZY2互为等电子体的分子的化学式:________。
(2)Y的氢化物(H2Y)在乙醇中的溶解度大于H2Z,其原因是________。
(3)含X2+的溶液与KCN、氨水反应可得到化合物K3[X(CN)5(NH3)]。1 mol配合物K3[X(CN)5(NH3)]中含σ键的数目为______。
(4)下图为X与Z所形成的一种化合物的基本结构单元,推测该化合物的化学式为______。

【答案】O 三角锥形 S2O或SeO2 H2O分子与乙醇分子间可形成氢键,而H2S不能 14 mol Fe3S8
【解析】
元素X位于第四周期,其基态原子有4个未成对电子,核外电子排布式为1s22s22p63s23p63d64s2,则X为Fe;Y原子最外层电子数是其内层电子总数的3倍,原子只能有2个电子层,最外层电子数为6,故Y为O元素;元素Z基态原子的3p轨道上有4个电子,核外电子排布式为1s22s22p63s23p4,则Z为S元素,据此答题。
(1)①同主族自上而下电负性减小,故电负性O>S,故答案为:O。
②离子SO32-中S原子孤电子对数=(6+2-2×3)÷2=1,价层电子对数=3+1=4,为三角锥形,故答案为:三角锥形。
③原子数目相等、价电子总数也相等的微粒互为等电子体,则一种与SO2互为等电子体的氧化物分子的化学式为:SeO2或S2O,故答案为:SeO2或S2O。
(2)H2O分子与乙醇分子间可形成氢键,而H2S不能,H2O在乙醇中的溶解度大于H2S,
故答案为:H2O分子与乙醇分子间可形成氢键,而H2S不能。
(3)氨气分子中有3个σ键,CN-中含有1个σ键,形成6个配位键,也属于σ键,1mol配合物K3[Fe(CN)5(NH3)]中含14molσ键,故答案为:14mol。
(4)根据均摊法,晶胞中S原子数目为4,Fe原子数目为1+4×1/8=1.5,Fe、S原子数目之比为3:8,故化学式为:Fe3S8,故答案为:Fe3S8。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案