题目内容
【题目】钴是人体不可或缺的微量元素之一。Co、Al、O形成的一种化合物钴蓝晶体结构如图所示。
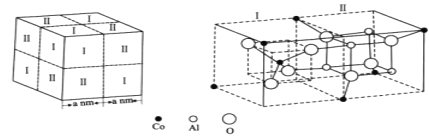
基态Co原子的价电子排布图为___。该立方晶胞由4个I型和4个Ⅱ型小立方体构成,其化学式为___,NA为阿伏加德罗常数的值,钴蓝晶体的密度为___g·cm-3(列计算式)。
【答案】![]() CoAl2O4
CoAl2O4 ![]()
【解析】
钴为27号元素;根据立方晶胞的结构可知,一个晶胞中含有钴原子的个数为![]() ,铝原子的个数为4
,铝原子的个数为4![]() 4=16,氧原子的个数为8
4=16,氧原子的个数为8![]() 4=32。
4=32。
基态Co原子的价电子排布式为3d74s2,则价电子排布图为![]() ;根据均摊法,一个晶胞中含有钴原子的个数为
;根据均摊法,一个晶胞中含有钴原子的个数为![]() ,铝原子的个数为4
,铝原子的个数为4![]() 4=16,氧原子的个数为8
4=16,氧原子的个数为8![]() 4=32,晶胞中Co、Al、O原子个数之比为8:16:32=1:2:4,则化学式为CoAl2O4;该晶胞的体积为(2a
4=32,晶胞中Co、Al、O原子个数之比为8:16:32=1:2:4,则化学式为CoAl2O4;该晶胞的体积为(2a ![]() 10-7cm)3,钴蓝晶体的密度
10-7cm)3,钴蓝晶体的密度![]() 。
。

练习册系列答案
相关题目
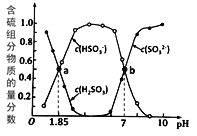
【题目】常温下,1mol化学键分解成气态原子所需要的能量用E表示,结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ·mol1) | 436 | 157 | 568 | 432 | 298 |
A. 表中最稳定的共价键是H-F
B. 1mol H2(g)与1mol F2(g)生成2molHF(g)放出25kJ的能量
C. 432kJ·mol1>E(H-Br)>298kJ·mol1
D. 1mol H2(g)分解成2mol H(g) 需吸收436kJ的能量